
- •Київ кнуБіА пробірочний практикум
- •Якісний аналіз органічних речовин
- •Лабораторна робота № 1 якісні реакції органічних речовин
- •Дослід і. Виявлення карбону й гідрогену
- •Дослід 2. Виявлення нітрогену за реакцією лассеня
- •Дослід 3. Виявлення сульфуру
- •Дослід 4. Виявлення галогенів
- •Вуглеводні
- •Насичені вуглеводні
- •Дослід 2. Взаємодія алканів із бромною водою і розчином калій перманганату
- •Дослід 3. Суха перегонка деревини
- •Етиленові та дієн0ві вуглеводні
- •Добування й властивості етиленових вуглеводнів (алкенів)
- •Дослід 1. Добування етилену і вивчення його властивостей
- •Ацетиленові вуглеводні (алкіни)
- •Добування й властивості ацетиленових вуглеводнів
- •Дослід 1. Добування ацетилену з карбіду кальцію та вивчення його властивостей
- •Дослід 5. Добування ацетиленіду аргентуму та ацетиленіду купруму
- •Ароматичні вуглеводні ( арени )
- •Лабораторна робота № 5 добування й властивості ароматичних вуглеводнів
- •Дослід 1. Добування бензену з бензоату натрію
- •Дослід 2. Взаємодія бензену із бромом
- •Дослід 3. Взаємодія гомологів бензену із бромом
- •З розчином калій перманганату
- •Дослід 6. Окислення гомологів бензену
- •Дослід 7. Нітрування бензену
- •Дослід 9. Сублімація нафталену
- •Дослід 10. Нітрування нафталену
- •Дослід 11. Бромування нафталену
- •Дослід 12. Сульфування нафталену
- •Галогенопохідні вуглеводнів
- •Лабораторна робота № 6 добування й властивості галогенопохідних
- •Дослід 1. Добування хлористого етилу
- •Дослід 2. Синтез брометану
- •Дослід 3. Добування йодоформу зi спирту
- •Дослід 5. Резорцинова проба на хлороформ, бромоформ та йодоформ
- •Дослід 6. Порівняння рухливості атомів галогену у бензеновому кільці та у боковому ланцюзі
- •Оксигенвмісні сполуки та їх похідні.
- •Одноатомні спирти
- •Лабораторна робота № 7 хімічні властивості одноатомних спиртів
- •Дослід 1. Розчинність спиртів у воді
- •Дослід 2. Виділення тепла під час розчинення етилового спирту у воді
- •Дослід 7. Окислення етилового спирту калій перманганатом
- •Дослід 8. Окислення спиртів оксидом купруму (II)
- •Дослід 9. Добування ectepib
- •Дослід 10. Виявлення сивушного масла у спирті
- •Дослід 11. Реакція на ненасичені одноатомні спирти
- •Багатоатомні спирти
- •Лабораторна робота № 8 хімічні властивості багатоатомних спиртів
- •Дослід 1. Взаємодія етиленгліколю з натрієм
- •Дослід 2. Утворення гліколяту і гліцерату купруму
- •Дослід 3. Дегідратація гліцерину
- •Феноли й ароматичні спирти
- •Лабораторна робота № 9 хімічні властивості фенолів і ароматичних спиртів
- •Дослід 1. Розчинність фенолу у воді та його кислотні властивості
- •Дослід 2. Добування феноляту натрію
- •Дослід 4. Утворення нафтолятів
- •Дослід 5. Сульфування фенолу
- •Дослід 7. Окислення фенолу
- •Дослід 8. Добування пікрату нафталену
- •Дослід 9. Добування ауріну
- •Дослід 10. Добування фенолфталеїну та його відношення до кислот і лугів
- •Лабораторна робота № 10 добування й властивості альдегідів і кетонів
- •Окисленням метанолу
- •Дослід 2. Добування оцтового альдегіду окисленням етанолу
- •Дослід 4. Реакція срібного дзеркала
- •Дослід 5. Реакція відновлення альдегідами гідроксиду купруму (II)
- •Дослід 6. Реакція відновлення альдегідами реактиву фелінга
- •Дослід 8. Взаємодія альдегідів із лугом
- •Дослід 9. Утворення альдегідами й кетонами гідросульфітних сполук
- •Дослід 11. Добування й розклад гексаметилентетраміну (уротропіну)
- •Дослід 13. Реакція канніццаро
- •Дослід 14. Виявлення ацетону
- •Дослід 15. Окислювальні властивості хінону
- •Карбонові кислоти та їх похідні одноосновні карбонові кислоти. Жири
- •Лабораторна робота №11
- •Карбонових кислот і жирів
- •Дослід 1. Розчинність карбонових кислот
- •Дослід 2. Виявлення карбонових кислот за допомогою індикаторів
- •Дослід 3. Утворення солей карбонових кислот
- •Дослід 4. Гідроліз солей карбонових кислот
- •Дослід 12. Гідроліз мила
- •Дослід 13. Взаємодія олеїнової кислоти із бромом
- •Дослід 15. Елаїдинова проба
- •Дослід 16. Акролеїнова проба на жири
- •Дослід 17. Визначення ненасиченост1 жиру
- •Дослід 18. Розчинність жирів
- •Двохосновні карбонові кислоти. Аміди кислот
- •Лабораторна робота № 12 хімічні властивості двохосновних карбонових кислот і амідів кислот
- •Дослід 2. Розкладання щавлевої кислоти під час нагрівання
- •Дослід 3. Утворення солі щавлевої кислоти
- •Дослід 4. Окислення щавлевої кислоти
- •Дослід 5. Декарбоксилування малонової кислоти
- •Дослід 6. Добування повного аміду щавлевої кислоти амонолізом естеру
- •Дослід 7. Гідроліз сечовини
- •Дослід 9. Взаємодія сечовини з нітритною кислотою
- •Дослід 10. Утворення біурету
- •Дослід 11. Взаємодія сечовини з гіпобромідом натрію (реакція о.П. Бородіна)
- •Ароматичні карбонові кислоти
- •Дослід 2. Добування бензоату феруму
- •Дослід 3. Добування фталевого ангідриду
- •Дослід 5. Декарбоксилування саліцилової кислоти
- •Дослід 6. Гідроліз аспірину
- •Дослід 7. Взаємодія галової кислоти й таніну з хлоридом феруму (III)
- •Нітрогенobmichi органічні сполуки hitpo- і аміносполуки жирного ряду
- •Дослід 3. Дія нітритної кислоти на первинні нітросполуки
- •Дослід 4. Дія нітритної кислоти на вторинні нітросполуки
- •Дослід 5. Добування метиламіну з ацетаміду
- •Дослід 6. Добування метиламіну з його солей
- •Дослід 7. Взаємодія амінів із солями феруму й купруму
- •Дослід 8. Реакція первинних аміносполук з нітритною кислотою
- •Аміносполуки ароматичного ряду
- •Дослід 7. Якісна реакція на дифеніламін
- •Діазо- і азосполуки
- •Лабораторна робота № 16 добування й властивості діазо- та азосполук
- •Дослід 1. Реакція діазотування
- •Дослід 3. Добування азобарвника анілінового жовтого (диметиламіноазобензену)
- •З фенолу та β-нафтолу
- •Сполуки зі змішаними функціональними групами. Оксикислоти та оксокислоти
- •Лабораторна робота №17 хімічні властивості окси- та оксокислот
- •Дослід 1. Виявлення молочної кислоти
- •Дослід 2. Розклад молочної кислоти під час нагрівання із сульфатною кислотою
- •Дослід 3. Окислення молочної кислоти у піровиноградну
- •Дослід 4. Утворення солей винної кислоти
- •Дослід 5. Взаємодія винної кислоти з гідроксидом купруму (іі)
- •Дослід 6. Розклад лимонної кислоти
- •Дослід 7. Таутомерія ацетооцтового естеру
- •Амінокислоти і білкові речовини
- •Лабораторна робота №18 хімічні властивості амінокислот і білків
- •Дослід 2. Утворення комплексної солі купруму амінооцтової кислоти
- •Дослід 6. Висолювання білків
- •Дослід 7. Кольорові реакції на білки
- •Вуглеводи моносахариди (монози)
- •Дослід 2. Окислення моноз оксидом аргентуму (реакція срібного дзеркала)
- •Дослід3. Окислення глюкози реактивом фелінга
- •Дослід 4. Дія лугу на моносахариди
- •Дослід 6. Реакція селіванова на кетогексози
- •Дисахариди
- •Лабораторна робота № 20 хімічні властивості дисахаридів
- •Дослід 1. Реакція на наявність гідроксильних груп у дисахаридах
- •Дослід 2. Відношення дисахаридів до фелінгової рідини
- •Дослід 3. Відношення дисахаридів до амоніачного розчину оксиду аргентуму
- •Дослід 4. Гідроліз (інверсія) сахарози
- •Дослід 5. Якісна реакція на сахарозу
- •Дослід 6. Утворення карамелі
- •Дослід 7. Виявлення молочного цукру (лактози) у молоці
- •Полісахариди (поліози, несахароподібні вуглеводи)
- •Дослід 2. Виявлення крохмалю в картоплі та зерні
- •Дослід 3. Розчинення клітковини у купрум-амоніачному розчині (реактив Швейцера)
- •Дослід 4. Розчинення клітковини в сульфатній кислоті
- •Дослід 5. Добування рослинного пергаменту (частковий гідроліз клітковини)
- •Дослід 6. Кислотний гідроліз пентозанів
- •Гетероциклічні сполуки
- •Лабораторна робота 22 хімічні властивості гетероциклічних сполук
- •Дослід 1. Кольорова реакція на пірол
- •Дослід 2. Кольорова реакція на фурфурол
- •Дослід 6. Добування пікрату піридину
- •Дослід 7. Відношення індиго до розчинників
- •Дослід 8. Сульфування індиго
- •Дослід 9. Окислення індиго
- •Дослід 10. Відновлення індиго
- •Дослід 11. Добування кофеїну з чаю
- •Полімери. Високомолекулярні сполуки
- •Лабораторна робота №23
- •Дослід 1. Добування полібутилметакрилату
Дослід 3. Взаємодія гомологів бензену із бромом
Гомологи бензену галогенуються значно легше, ніж бензен, причому залежно від умов реакції галоген заміщує атоми Гідрогену в бензеновому ядрі або в боковому ланцюзі.
До 2 мл толуену добавляють 2–3 мл розчину брому в тетрахлорметані, вносять 0,1–0,2 г залізних ошурок як каталізатор. Суміш нагрівають. Поступово спостерігається зникнення забарвлення й енергійне виділення бромоводню.. При цьому утворюється орто- і парабромтолуен:

Якщо реакції проводити при нагріванні на світлі і без каталізатора, то бром заміщає Гідроген тільки в боковому ланцюзі з утворенням бромистого бензилу:

Дослід 4. ОДЕРЖАННЯ ТРИБРОМФЕНОЛУ
В пробірку з 3мл бромної води наливають при перемішуванні по краплинам 3мл розчину фенолу. Утворюється осад трибромфенолу. Записати рівняння реакції по стадіям. Пояснити чому заміщення проходить в певні положення бензенового кільця.
Дослід 5. ВЗАЄМОДІЯ БЕНЗЕНУ
З розчином калій перманганату
У пробірку наливають 2–3 мл бензену, добавляють 2 мл 0,1 %-ного розчину калій перманганату, дві-три краплини 10 %-ного розчину сульфатної кислоти і збовтують. Забарвлення розчину калій перманганату не змінюється навіть під час нагрівання, що вказує на стійкість бензенового ядра до окисників.
Дослід 6. Окислення гомологів бензену
Гомологи бензену здатні окиснюватися з утворенням ароматичних карбонових кислот. В одну пробірку наливають 2–3 мл толуену, у другу — стільки ж о-ксилену. В кожну пробірку добавляють по 2 мл 0,5 %-ного розчину калій перманганату і дві-три краплі 10 % -ного розчину сульфатної кислоти. Під час перемішування і обережного нагрівання забарвлення калій перманганату змінюється й виділяється оксид мангану (IV). Кожний боковий ланцюг при цьому окиснюється в карбоксильну групу.
Толуен окиснюється до бензенової кислоти:

о-ксилен утворює фталеву кислоту:

Дослід 7. Нітрування бензену
У пробірку до нітруючої суміші, що складається з 2 мл сульфатної та 1 мл нітратної концентрованих кислот, доливають по краплях при перемішуванні 1 мл бензену. Перемішування продовжують ще кілька хвилин. Потім вміст пробірки виливають у хімічну склянку з 10–15 мл води. Нітробензен виділяється у вигляді маслянистої рідини на дні хімічної склянки. Про утворення нітробензену свідчить характерний запах гіркого мигдалю:
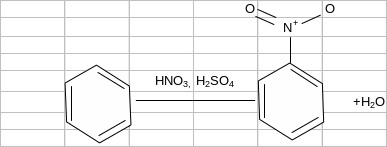
Сульфатна кислота зв'язує воду, утворювану під час реакції, і тим самим запобігає розбавленню нітратної кислоти, а також бере участь в утворенні іона нітронію відповідно до рівняння реакції: HNO3 + 2H2SO4 → NO2+ + H3O+ + 2HSO4.
Дослід 8. СУЛЬФУВАННЯ БЕНЗЕНУ І ЙОГО ГОМОЛОГІВ
Утворення бензенсульфокислоти. У пробірку з повітряним холодильником наливають З мл димучої сульфатної кислоти і по краплях додають 2 мл бензену. Суміш нагрівається, і бензен поступово розчиняється.
Реакційну суміш обережно підігрівають на водяній бані. Після охолодження розчин виливають у склянку з 30–40 мл насиченого розчину хлориду натрію. При цьому використовується натрієва сіль бензенсульфокислоти:

Утворення толуенсульфокислоти. У пробірку з повітряним холодильником наливають до 1 мл толуену, додають 3 мл концентрованої сульфатної кислоти. Реакція проходить із виділенням тепла, і толуен поступово розчиняється в кислоті. Для закінчення реакції суміші обережно нагрівають на водяній бані протягом 10–15 хв, час від часу суміш збовтують. Нагрівання закінчують коли суміш стає однорідною. Охолоджену реакційну суміш виливають у склянку з 10–15 мл насиченого розчину хлориду натрію. Випадають кристали натрієвої солі п-толуенсульфокислоти з домішками о-ізомеру:

