
- •Все вещества состоят из атомов или молекул
- •Атомы и молекулы веществ находятся в состоянии беспорядочного движения
- •Между атомами и молекулами вещества действуют как силы притяжения, так и силы отталкивания.
- •2. Давление
- •3. Уравнение состояния идеального газа
- •4. Законы идеальных газов
- •Изотермический процесс
- •Изобарический процесс
- •Изохорический процесс
- •Закон Авогадро
- •Закон Дальтона
- •5. Барометрическая формула
- •З акон Больцмана
- •6. Распределение молекул по скоростям
- •7. Функция распределения
- •9. Формула Максвелла
- •10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул
- •11. Кинетическая теория теплоты Внутренняя энергия идеального газа
- •12. Первое начало термодинамики
- •§5. Макроскопическая работа
- •13. Различные приложения I начала термодинамики. Теплоёмкость
- •15, 16 Классическая теория теплоёмкости и её недостатки
- •19. Адиабатический процесс. Уравнение Пуассона
- •20. Работа при адиабатическом изменении объёма газа
- •21. Политропический процесс
- •22. Столкновение молекул и явления переноса
- •§2. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- •§3. Рассеяние молекулярного пучка в газе
- •23. Явление переноса в газах. Уравнение переноса
- •24. Диффузия
- •25. Теплопроводность газов
- •26. Вязкость газов (внутреннее трение)
- •28. Неидеальные газы. Уравнение Ван-дер-Ваальса. Отклонение свойств газов от идеальности
- •29. Фаза и фазовые равновесия
- •30. Уравнение Ван-Дер-Ваальса
- •31. Изотермы Ван-дер-Ваальса
- •32. Критическая температура и критическое состояние
- •33. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- •34. Равновесные состояния
- •Обратимые и необратимые процессы
- •35. Необратимость и вероятность
- •37. Внутренняя энергия
- •38. Цикл Карно
- •39. Коэффициент полезного действия в цикле Карно
- •. Холодильная машина
- •40. Свободная энергия
- •41. Энтропия
- •42. Некоторые термодинамические соотношения
- •44 Закон возрастания энтропии. Второе начало термодинамики
- •Увеличение энтропии при теплопередаче
- •45. Энтропия и вероятность
- •46 Энтропия и беспорядок
- •47. Третье начало термодинамики
- •§9. Сжижение газов
- •48. Эффект Джоуля-Томсона
- •50. Строение жидкостей
- •51. Поверхностное натяжение
- •52. Условия равновесия на границе двух сред. Краевой угол
- •53. Силы, возникающие на кривой поверхности жидкости
- •54. Капиллярные явления
- •55. Упругость насыщенного пара над кривой поверхностью жидкости
- •56. Условия равновесия фаз химически однородного вещества
- •§3. Уравнение Клапейрона
9. Формула Максвелла
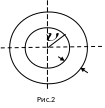 Концентрация,
определяемая формулой (3.49) не может
зависеть от направления вектора скорости
.
Поэтому мы можем найти функцию
распределения молекул по скоростям,
независимо от их направления. Действительно,
если собрать все молекулы единицы
объема, скорости которых лежат в пределах
от
до
,
независимо от их направления и выпустить
их, то они, разлетаясь по всем направлениям,
через одну секунду окажутся равномерно
распределенными в шаровом слое толщиной
и
радиусом
.
Это шаровой слой сложится из тех
«кубиков», о которых говорилось выше.
Плотность числа молекул или концентрация
будет определяться опять формулой
(3.49).Число молекул в шаровом слое будет
равно произведению плотности молекул
(формула (3.49) на объем шарового слоя
Концентрация,
определяемая формулой (3.49) не может
зависеть от направления вектора скорости
.
Поэтому мы можем найти функцию
распределения молекул по скоростям,
независимо от их направления. Действительно,
если собрать все молекулы единицы
объема, скорости которых лежат в пределах
от
до
,
независимо от их направления и выпустить
их, то они, разлетаясь по всем направлениям,
через одну секунду окажутся равномерно
распределенными в шаровом слое толщиной
и
радиусом
.
Это шаровой слой сложится из тех
«кубиков», о которых говорилось выше.
Плотность числа молекул или концентрация
будет определяться опять формулой
(3.49).Число молекул в шаровом слое будет
равно произведению плотности молекул
(формула (3.49) на объем шарового слоя
![]() ,
т.е
,
т.е
![]() (3.50)
(3.50)
Если сравнить эту формулу с выражением (3.40), получим следующее выражение для функции распределения молекул по скоростям:
![]() .
(3.51)
.
(3.51)
Эта функция называется функцией распределения Максвелла.
В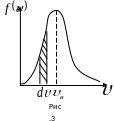
 ид
этой функции приведен на рис. 3. Как видно
из графика, функция обращается в нуль
при
ид
этой функции приведен на рис. 3. Как видно
из графика, функция обращается в нуль
при
![]() и
и
![]() ,
т.е. число неподвижных молекул, как и
число молекул, движущихся с очень большой
скоростью, равна нулю. Из кривой видно,
что существует такая скорость
,
т.е. число неподвижных молекул, как и
число молекул, движущихся с очень большой
скоростью, равна нулю. Из кривой видно,
что существует такая скорость
![]() ,
которой обладает максимальная доля
молекул. Эта скорость называется
наивероятнейшей скоростью.
,
которой обладает максимальная доля
молекул. Эта скорость называется
наивероятнейшей скоростью.
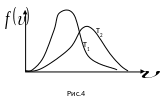
Пользуясь кривой распределения Максвелла, можно графически определить число молекул, обладающих скоростями в заданном интервале и . Это число выражается площадью с основанием и высотой . Распределение молекул по скоростям по формуле (3.51) зависит от температуры газа. Эта зависимость приведена на рис.4, из которого следует, что с повышением температуры скорости молекул возрастают, и вся кривая смещается в сторону больших скоростей. Площади, ограниченные этими кривыми и осью скоростей, пропорциональны общему числу частиц и не могут изменяться с температурой. Вследствие этого, максимумы кривых с повышением температуры понижаются. Надо отметить, что распределение Максвелла по скоростям является равновесным распределением. При отклонении система от состояния равновесия, максвелловское распределение нарушается. При возвращении в состояние равновесия благодаря столкновениям устанавливается опять максвелловское распределение.
Распределение Максвелла связано хаотичным движением молекул. Движение молекул полностью хаотично, если они распределены по скоростям в соответствии с формулой Максвелла. В противном случае, движением молекул является частично упорядоченным.
10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул
Используя функцию распределения Максвелла можно вычислить значение средней скорости молекул. Согласно определению, средняя скорость определяется выражением
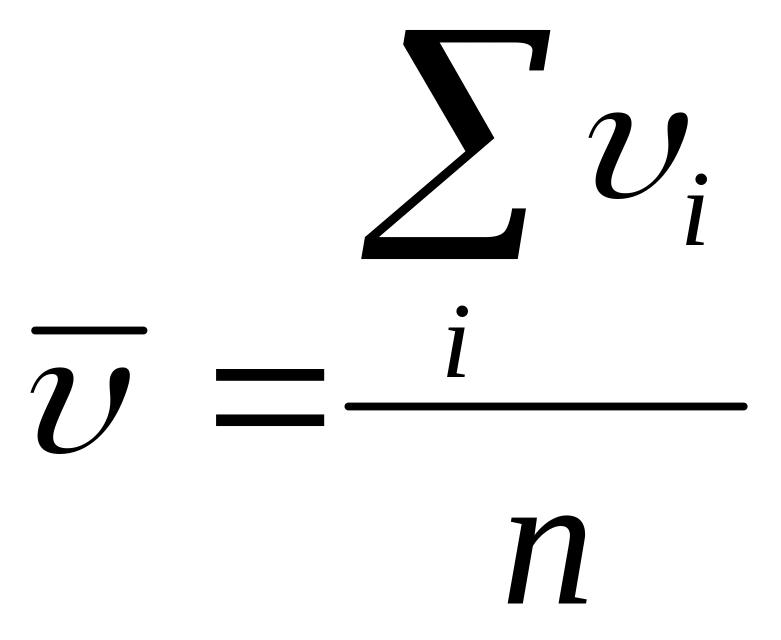 ,
,
где
![]() -
скорость
-
скорость
![]() той
молекулы. Сумму скоростей молекул можно
найти из следующих соображений:
той
молекулы. Сумму скоростей молекул можно
найти из следующих соображений:
![]() -
это число молекул единицы объема,
скорости которых заключены в интервале
от
до
вблизи
значения
.
Умножив это выражение на
,
получим сумму скоростей этих молекул,
равную
-
это число молекул единицы объема,
скорости которых заключены в интервале
от
до
вблизи
значения
.
Умножив это выражение на
,
получим сумму скоростей этих молекул,
равную
![]() .
Тогда
.
Тогда
![]() представляет
сумму скоростей всех молекул в единице
объема. Следовательно, средняя
арифметическая скорость равна:
представляет
сумму скоростей всех молекул в единице
объема. Следовательно, средняя
арифметическая скорость равна:
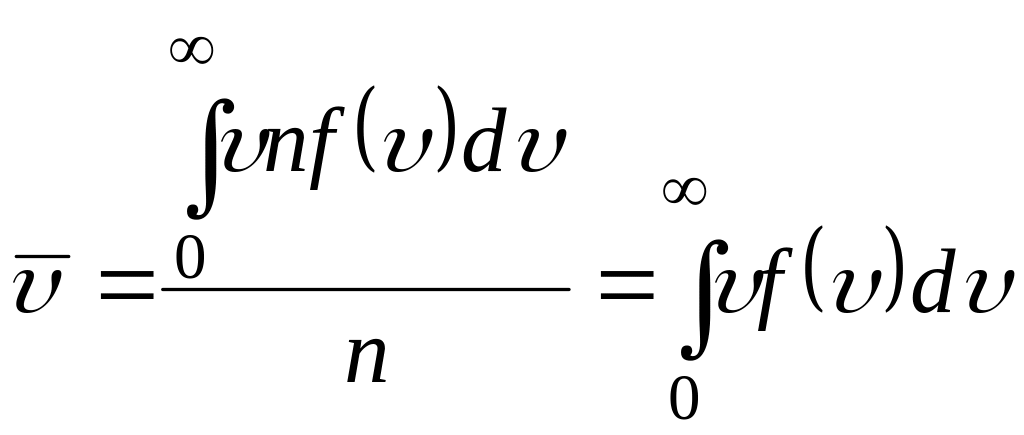 .
(3.52)
.
(3.52)
Используя выражение (3.51) для функции распределения Максвелла , можем записать:
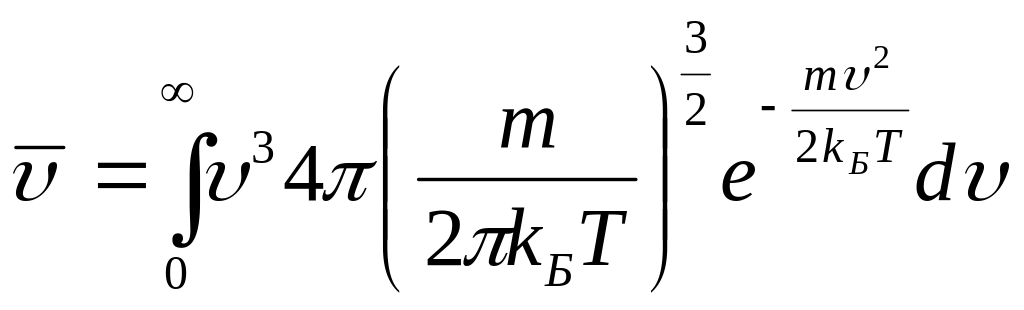 .
.
Интегрируя по частям, имеем:
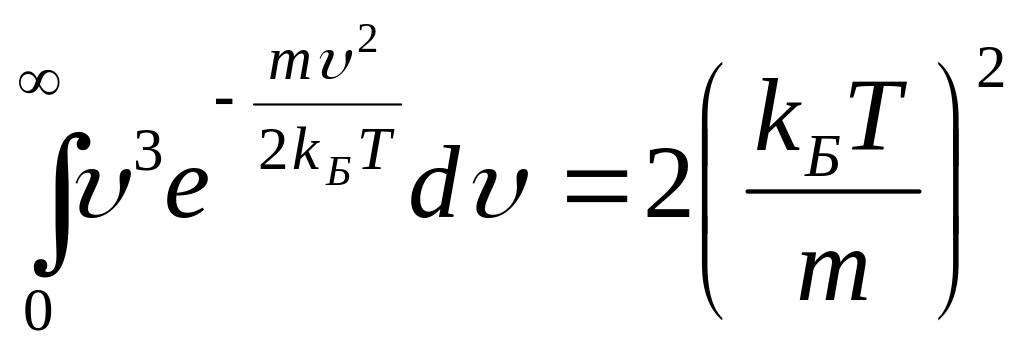 .
.
Подставляя это значение интеграла в формулу (3.52), получим:
![]() .
(3.53)
.
(3.53)
Для
определения среднеквадратичной скорости,
воспользуясь формулой (3.52), определим
среднее значение квадрата скорости
![]() :
:
![]() .
.
Поставив в эту формулу выражение для функции распределения Максвелла, получим:
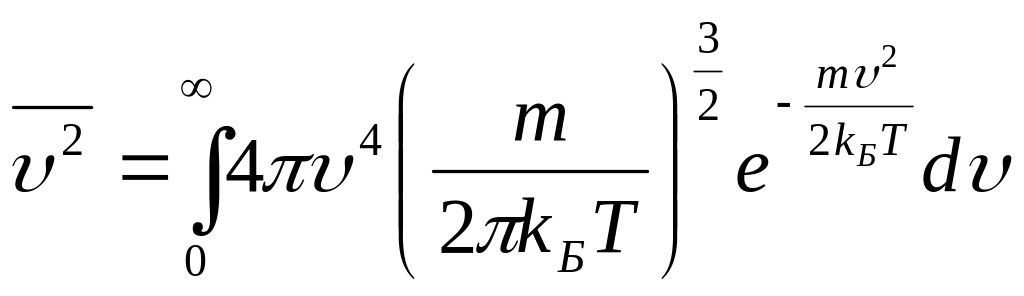 .
(3.54)
.
(3.54)
Интегрируя по частям, можно показать, что
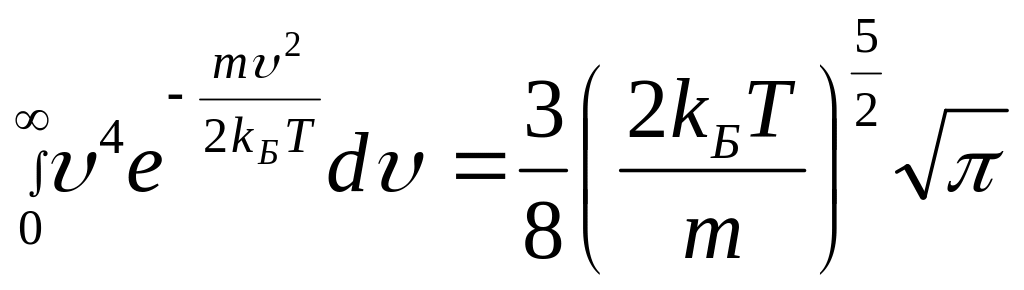 ,
,
откуда
![]() .
.
Тогда
среднеквадратичная скорость
![]() будет
равна:
будет
равна:
=![]() .
(3.55)
.
(3.55)
Вычислим
теперь наивероятнейшую скорость молекул
![]() ,
которую имеют наибольшее число молекул
газа. При этой скорости кривая распределения
Максвелла проходит через максимум. Для
определения
,
которую имеют наибольшее число молекул
газа. При этой скорости кривая распределения
Максвелла проходит через максимум. Для
определения
![]() напишем
условие максимума функции распределения
Максвелла:
напишем
условие максимума функции распределения
Максвелла:
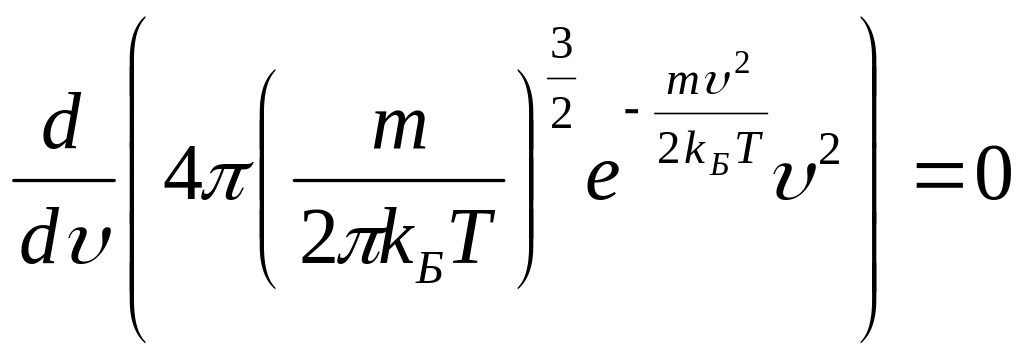 .
.
Дифференцируя это выражение, получим:
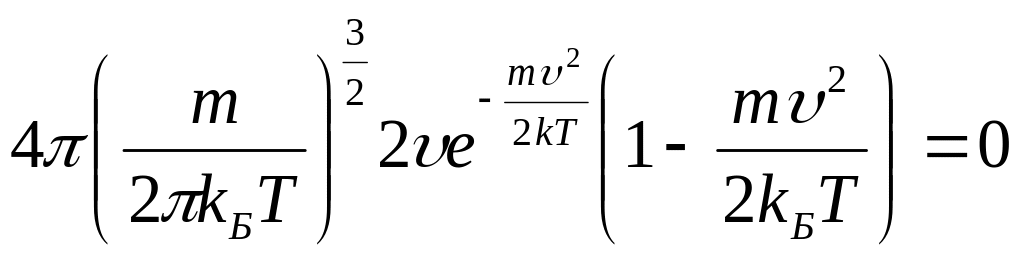 ,
,
Это
равенство может быть выполнено либо
при
,
либо при
![]() ,
или при условии
,
или при условии
![]() .
Очевидно, что первые два случая не
соответствуют максимуму кривой.
Следовательно, наивероятнейшая скорость
определяется из условия
.
Очевидно, что первые два случая не
соответствуют максимуму кривой.
Следовательно, наивероятнейшая скорость
определяется из условия
![]() ,
откуда
,
откуда
![]() .
(3.56)
.
(3.56)
Сравнивая выражения (3.53), (3.55) и (3.56), найдем соотношения между тремя вычисленными скоростями:
![]() .
.
