
- •Все вещества состоят из атомов или молекул
- •Атомы и молекулы веществ находятся в состоянии беспорядочного движения
- •Между атомами и молекулами вещества действуют как силы притяжения, так и силы отталкивания.
- •2. Давление
- •3. Уравнение состояния идеального газа
- •4. Законы идеальных газов
- •Изотермический процесс
- •Изобарический процесс
- •Изохорический процесс
- •Закон Авогадро
- •Закон Дальтона
- •5. Барометрическая формула
- •З акон Больцмана
- •6. Распределение молекул по скоростям
- •7. Функция распределения
- •9. Формула Максвелла
- •10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул
- •11. Кинетическая теория теплоты Внутренняя энергия идеального газа
- •12. Первое начало термодинамики
- •§5. Макроскопическая работа
- •13. Различные приложения I начала термодинамики. Теплоёмкость
- •15, 16 Классическая теория теплоёмкости и её недостатки
- •19. Адиабатический процесс. Уравнение Пуассона
- •20. Работа при адиабатическом изменении объёма газа
- •21. Политропический процесс
- •22. Столкновение молекул и явления переноса
- •§2. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- •§3. Рассеяние молекулярного пучка в газе
- •23. Явление переноса в газах. Уравнение переноса
- •24. Диффузия
- •25. Теплопроводность газов
- •26. Вязкость газов (внутреннее трение)
- •28. Неидеальные газы. Уравнение Ван-дер-Ваальса. Отклонение свойств газов от идеальности
- •29. Фаза и фазовые равновесия
- •30. Уравнение Ван-Дер-Ваальса
- •31. Изотермы Ван-дер-Ваальса
- •32. Критическая температура и критическое состояние
- •33. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- •34. Равновесные состояния
- •Обратимые и необратимые процессы
- •35. Необратимость и вероятность
- •37. Внутренняя энергия
- •38. Цикл Карно
- •39. Коэффициент полезного действия в цикле Карно
- •. Холодильная машина
- •40. Свободная энергия
- •41. Энтропия
- •42. Некоторые термодинамические соотношения
- •44 Закон возрастания энтропии. Второе начало термодинамики
- •Увеличение энтропии при теплопередаче
- •45. Энтропия и вероятность
- •46 Энтропия и беспорядок
- •47. Третье начало термодинамики
- •§9. Сжижение газов
- •48. Эффект Джоуля-Томсона
- •50. Строение жидкостей
- •51. Поверхностное натяжение
- •52. Условия равновесия на границе двух сред. Краевой угол
- •53. Силы, возникающие на кривой поверхности жидкости
- •54. Капиллярные явления
- •55. Упругость насыщенного пара над кривой поверхностью жидкости
- •56. Условия равновесия фаз химически однородного вещества
- •§3. Уравнение Клапейрона
15, 16 Классическая теория теплоёмкости и её недостатки
Как было показано в разделе термодинамики, теплоёмкость при постоянном объёме определяется формулой
![]() .
(3.27)
.
(3.27)
Используя выражение (3.26) для внутренней энергии одного моля идеального газа получим следующее выражение для молярной теплоёмкости при постоянном объёме.
![]() .
(3.28)
.
(3.28)
Из уравнения Майера следует, что молярная теплоёмкость при постоянном давлении равна
![]() .
(3.29)
.
(3.29)
С помощью формул (3.28) и (3.29) можно получить следующее выражение для адиабатической постоянной g
![]() .
(3.30)
.
(3.30)
Сравнение классической
теории теплоёмкости с опытными данными
показывают, что при определённых условиях
теплоёмкости, вычисленные по формулам
(3.29) и (3.30) близки к экспериментальным
результатам. Для атомарного газа i=3,![]() ,
,
![]() .
Для сравнения в таблице №1 приведен
экспериментальный результат для
различных газов.
.
Для сравнения в таблице №1 приведен
экспериментальный результат для
различных газов.
Газ |
|
|
|
Гелий |
1,519 |
1,001 |
1,659 |
Неон |
- |
- |
1,64 |
Аргон |
1,5 |
1,008 |
1,67 |
Криптон |
- |
- |
1,68 |
Ксенон |
- |
- |
1,66 |
И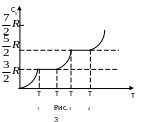 з
таблицы следует, что теория достаточно
точно определяет теплоёмкость идеального
газа.
з
таблицы следует, что теория достаточно
точно определяет теплоёмкость идеального
газа.
Из классической
теории теплоёмкости (3.28) и (3.29) следует,
что теплоёмкость идеального газа
является постоянной величиной, не
зависящей от температуры. В действительности,
как показывает опыт, теплоёмкость газа
зависит от температуры. На рисунке
приведён график зависимости молярной
теплоёмкости газообразного водорода
от температуры. Как видим из рисунка,
теплоёмкость CV
газообразного водорода совпадает со
значением
![]() ,
вытекающим из классической теории
только в области температур T3-T4.
В области температур T1-T2
теплоёмкость газообразного водорода
принимает значение
,
вытекающим из классической теории
только в области температур T3-T4.
В области температур T1-T2
теплоёмкость газообразного водорода
принимает значение
![]() ,
свойственное теплоёмкости атомарного
газа. Это говорит о том, что классическая
теория теплоёмкости справедлива только
в ограниченной области температур.
По-видимому, это связано с тем, что
эффективный вклад в теплоёмкость вносит
не все, а только некоторые степени
свободы. При понижении температуры
некоторые степени свободы становятся
малоэффективными, их вклад исчезает.
Про такие степени свободы говорят, что
они «заморожены». Наоборот, при повышении
температуры начинает проявляться всё
новые степени свободы, которые ранее
были либо малоэффективны, либо совсем
заморожены. Это значит, что классический
закон равномерного распределения
энергии по степеням свободы не справедлив
и требует уточнения.
,
свойственное теплоёмкости атомарного
газа. Это говорит о том, что классическая
теория теплоёмкости справедлива только
в ограниченной области температур.
По-видимому, это связано с тем, что
эффективный вклад в теплоёмкость вносит
не все, а только некоторые степени
свободы. При понижении температуры
некоторые степени свободы становятся
малоэффективными, их вклад исчезает.
Про такие степени свободы говорят, что
они «заморожены». Наоборот, при повышении
температуры начинает проявляться всё
новые степени свободы, которые ранее
были либо малоэффективны, либо совсем
заморожены. Это значит, что классический
закон равномерного распределения
энергии по степеням свободы не справедлив
и требует уточнения.
Эти трудности были преодолены после того, как теория теплоёмкости была построена на основе квантовой теории. Согласно квантовой теории, в отличие от классической, внутренняя энергия атомных систем может принимать лишь дискретные значения. Двухатомную молекулу, когда речь идёт о малых колебаниях её атомов относительно друг друга, можно рассматривать как гармонический осциллятор. Согласно квантовой теории возможные значения колебательной энергии такой системы представляются формулой
![]() ,
,
где n– частота осциллятора, n – целое число, которое может принять значения 0,1,2,3,…, h- универсальная постоянная, называемая постоянной Планка.
Таким образом,
энергетический спектр гармонического
осциллятора состоит из бесконечного
множества равностоящих уровней.
Расстояние между соседними уровнями
равно hn.
Самому низкому уровню соответствует
энергия![]() .
Воздействуя на осциллятор его можно
возбудить, т.е. перевести на один из
возможных более высоких уровней энергии.
Ближайшим является энергетический
уровень с n=1
и энергией
.
Воздействуя на осциллятор его можно
возбудить, т.е. перевести на один из
возможных более высоких уровней энергии.
Ближайшим является энергетический
уровень с n=1
и энергией
![]() .
.
Пусть имеем газ, состоящий из двухатомных молекул, т. е. из гармонических осцилляторов. Предположим, что температура газа настолько низка, что kБТ£hn.Тогда средняя энергия теплового движения молекул будет порядка kБТ и такая энергия недостаточна, чтобы возбудить осциллятор, т.е. перевести его с нулевого уровня на ближайший первый уровень. Возбуждение может происходить только при столкновениях с молекулами, энергия которых равно или больше порции энергии hn. Однако таких молекул относительно мало, так что практически все молекулы останутся на нижнем энергетическом уровне. Моделью жёсткой двухатомной молекулы в теории теплоёмкости можно пользоваться лишь при соблюдении условия kБТ<hn. При повышении температуры, когда величина kБТ становиться сравнимой с hn начинает возбуждаться первый, а затем более высокий колебательные уровни двухатомной молекулы.
Совершенно аналогично влияет на теплоёмкость газов и вращение молекул. Энергия вращения также принимает дискретные значения. Её возможные значения по квантовой механике определяется формулой
![]() ,
,
где I –момент инерции молекулы, l – целое число, которое может принимать значения 0,1,2,3…. Расстояния между уровнями энергии не постоянны, а возрастают в арифметической прогрессии. В состоянии с наименьшей энергией при l=0 вращения не возбуждены. В состоянии с l=1 энергия вращения равна
![]() .
.
Если kБТ
<e1,
то средней тепловой энергии молекулы
недостаточно для возбуждения вращений.
В этом случае при вычислении теплоемкости
вращение молекул можно не учитывать. В
противоположном случае, когда
![]() >>e1
, возбуждается
много вращательных уровней и необходимо
учитывать вращение молекул.
>>e1
, возбуждается
много вращательных уровней и необходимо
учитывать вращение молекул.
На основе приведённых данных объясним ход графика, приведённого на рисунке.
В области T1-T2
тепловая энергия молекул kБT
намного
меньше
![]() ,
соответственно и kБT
<hn,
в результате чего и вращательные и
колебательные степени свободы заморожены.
Теплоёмкость водорода в этой области
температур равна
,
соответственно и kБT
<hn,
в результате чего и вращательные и
колебательные степени свободы заморожены.
Теплоёмкость водорода в этой области
температур равна
![]() ,
которая совпадает с теплоёмкостью
атомарного газа, в котором атомы совершают
только поступательные движения. В
области температур T2-T3
теплоёмкость газа возрастает, это
связано с тем, что у некоторых молекул
начинает возбуждаться вращательные
степени свободы, причём, чем выше
температура, тем больше таких молекул.
При температуре T3
оказывается возбуждёнными вращательные
степени свободы всех молекул и теплоёмкость
газа становиться равной
,
которая совпадает с теплоёмкостью
атомарного газа, в котором атомы совершают
только поступательные движения. В
области температур T2-T3
теплоёмкость газа возрастает, это
связано с тем, что у некоторых молекул
начинает возбуждаться вращательные
степени свободы, причём, чем выше
температура, тем больше таких молекул.
При температуре T3
оказывается возбуждёнными вращательные
степени свободы всех молекул и теплоёмкость
газа становиться равной
![]() ,
что совпадает с классическим значением
теплоёмкости двухатомного газа. При
дальнейшем увеличении температуры с
T4,
и выше теплоёмкость водорода начинает
расти. Это объясняется тем, что в этой
области температур, тепловая энергия
молекул становиться достаточной для
возбуждения колебательных степеней
свободы.
,
что совпадает с классическим значением
теплоёмкости двухатомного газа. При
дальнейшем увеличении температуры с
T4,
и выше теплоёмкость водорода начинает
расти. Это объясняется тем, что в этой
области температур, тепловая энергия
молекул становиться достаточной для
возбуждения колебательных степеней
свободы.
