
- •Все вещества состоят из атомов или молекул
- •Атомы и молекулы веществ находятся в состоянии беспорядочного движения
- •Между атомами и молекулами вещества действуют как силы притяжения, так и силы отталкивания.
- •2. Давление
- •3. Уравнение состояния идеального газа
- •4. Законы идеальных газов
- •Изотермический процесс
- •Изобарический процесс
- •Изохорический процесс
- •Закон Авогадро
- •Закон Дальтона
- •5. Барометрическая формула
- •З акон Больцмана
- •6. Распределение молекул по скоростям
- •7. Функция распределения
- •9. Формула Максвелла
- •10. Средняя арифметическая, средняя квадратичная и наивероятнейшая скорости молекул
- •11. Кинетическая теория теплоты Внутренняя энергия идеального газа
- •12. Первое начало термодинамики
- •§5. Макроскопическая работа
- •13. Различные приложения I начала термодинамики. Теплоёмкость
- •15, 16 Классическая теория теплоёмкости и её недостатки
- •19. Адиабатический процесс. Уравнение Пуассона
- •20. Работа при адиабатическом изменении объёма газа
- •21. Политропический процесс
- •22. Столкновение молекул и явления переноса
- •§2. Среднее число столкновений в единицу времени и средняя длина свободного пробега молекул
- •§3. Рассеяние молекулярного пучка в газе
- •23. Явление переноса в газах. Уравнение переноса
- •24. Диффузия
- •25. Теплопроводность газов
- •26. Вязкость газов (внутреннее трение)
- •28. Неидеальные газы. Уравнение Ван-дер-Ваальса. Отклонение свойств газов от идеальности
- •29. Фаза и фазовые равновесия
- •30. Уравнение Ван-Дер-Ваальса
- •31. Изотермы Ван-дер-Ваальса
- •32. Критическая температура и критическое состояние
- •33. Приведенное уравнение Ван-дер-Ваальса. Закон соответственных состояний
- •34. Равновесные состояния
- •Обратимые и необратимые процессы
- •35. Необратимость и вероятность
- •37. Внутренняя энергия
- •38. Цикл Карно
- •39. Коэффициент полезного действия в цикле Карно
- •. Холодильная машина
- •40. Свободная энергия
- •41. Энтропия
- •42. Некоторые термодинамические соотношения
- •44 Закон возрастания энтропии. Второе начало термодинамики
- •Увеличение энтропии при теплопередаче
- •45. Энтропия и вероятность
- •46 Энтропия и беспорядок
- •47. Третье начало термодинамики
- •§9. Сжижение газов
- •48. Эффект Джоуля-Томсона
- •50. Строение жидкостей
- •51. Поверхностное натяжение
- •52. Условия равновесия на границе двух сред. Краевой угол
- •53. Силы, возникающие на кривой поверхности жидкости
- •54. Капиллярные явления
- •55. Упругость насыщенного пара над кривой поверхностью жидкости
- •56. Условия равновесия фаз химически однородного вещества
- •§3. Уравнение Клапейрона
24. Диффузия
П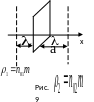 усть
в некотором объеме газа имеет место
неоднородность в отношении плотности
,
причем плотность
убывает в
направлении оси Х.
Предположим,
усть
в некотором объеме газа имеет место
неоднородность в отношении плотности
,
причем плотность
убывает в
направлении оси Х.
Предположим,
что плотности на
расстоянии
влево и вправо
от площади
,
равны соответственно
![]() и
и
![]() (Рис.9).
Тогда
(Рис.9).
Тогда
![]() >
.
Поскольку
>
.
Поскольку
![]() ,
где
,
где
![]() - масса
молекулы, одинаковое для всех молекул
газа,
- масса
молекулы, одинаковое для всех молекул
газа,
![]() .
Переносимой величиной в случае диффузии
является масса, т.е.
.
Переносимой величиной в случае диффузии
является масса, т.е.
![]() .
Тогда в
выражении (4.3)
.
Тогда в
выражении (4.3)
![]() ,
,
![]() .
.
Окончательно имеем:
![]() .
(4.4)
.
(4.4)
![]() - масса газа,
переносимая благодаря диффузии через
площадь
,
перпендикулярной направлению оси Х,
за время
.
В термодинамике необратимых процессов
уравнение диффузии определяется
эмпирическим законом Фика:
- масса газа,
переносимая благодаря диффузии через
площадь
,
перпендикулярной направлению оси Х,
за время
.
В термодинамике необратимых процессов
уравнение диффузии определяется
эмпирическим законом Фика:
![]() ,
(4.5)
,
(4.5)
где D- коэффициент диффузии. Из уравнений (4.4) и (4.5) следует, что коэффициент диффузии определяется следующим выражением:
![]() .
(4.6)
.
(4.6)
Единица измерения
коэффициента диффузии в системе СИ
![]() .
.
Рассмотрим, как
зависит коэффициент диффузии от
термодинамических параметров. Из формулы
(4.6) следует, что
![]() ,
поскольку
не зависит от давления, а
.
Таким образом, с ростом давления Р
коэффициент диффузии уменьшается.
Определим зависимость коэффициента
диффузии от температуры. Так как длина
свободного пробега практически не
зависит от температуры, а
,
поскольку
не зависит от давления, а
.
Таким образом, с ростом давления Р
коэффициент диффузии уменьшается.
Определим зависимость коэффициента
диффузии от температуры. Так как длина
свободного пробега практически не
зависит от температуры, а
![]() ,
имеем
,
имеем
![]() .
Кроме того, D
зависит от
сорта газа, эта зависимость определяется
тем, что в выражении для коэффициента
диффузии входит молярная масса газа
.
Кроме того, D
зависит от
сорта газа, эта зависимость определяется
тем, что в выражении для коэффициента
диффузии входит молярная масса газа
![]() .
.
25. Теплопроводность газов
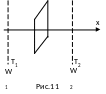
Пусть в некотором
объеме газа температура Т
убывает в направлении оси Х,
т.е.
![]() (рис.11).
Поскольку кинетическая энергия молекулы
определяется как
(рис.11).
Поскольку кинетическая энергия молекулы
определяется как
![]() ,
,
![]() .
Поэтому в сторону убывания температуры
будет происходить преимущественный
перенос энергии, следовательно, и
теплоты. В случае данной задачи
переносимый молекулами физической
характеристикой является
.
Поэтому в сторону убывания температуры
будет происходить преимущественный
перенос энергии, следовательно, и
теплоты. В случае данной задачи
переносимый молекулами физической
характеристикой является
кинетическая
энергия, т.е.
![]() .
Будем считать, что
.
Будем считать, что
![]() одинакова
во всем объеме. Тогда величины, входящие
в уравнение переноса, выразятся следующим
образом:
одинакова
во всем объеме. Тогда величины, входящие
в уравнение переноса, выразятся следующим
образом:
![]() ,
,
где
![]() ,
,
![]() .
.
![]() -
количество внутренней энергии, переносимое
за время
через площадку
перпендикулярно
направлению переноса. Подставляя эти
выражения в уравнение переноса (4.3),
получим:
-
количество внутренней энергии, переносимое
за время
через площадку
перпендикулярно
направлению переноса. Подставляя эти
выражения в уравнение переноса (4.3),
получим:
![]() .
(4.11)
.
(4.11)
Умножив числитель
и знаменатель уравнения (4.11) на
![]() ,
где
,
где
![]() -масса
молекулы,
-масса
молекулы,
![]() -число
Авогадро и учитывая, что
-число
Авогадро и учитывая, что
![]() ,
перепишем (4.11) в виде:
,
перепишем (4.11) в виде:
![]() ,
(4.12)
,
(4.12)
где
![]() -молярная
теплоемкость при постоянном объеме,
-молярная
теплоемкость при постоянном объеме,
![]() -молярная
масса. Так как
-молярная
масса. Так как
![]() -удельная
теплоемкость, из (4.11) окончательно
получим уравнение теплопроводности:
-удельная
теплоемкость, из (4.11) окончательно
получим уравнение теплопроводности:
![]() .
(4.13)
.
(4.13)
Эмпирически явление теплопроводности описывалось уравнением Фурье
![]() ,
(4.14)
,
(4.14)
где
![]() называется
коэффициентом теплопроводности. Из
(4.13) и (4.14) следует, что выражение для
коэффициента теплопроводности имеет
вид:
называется
коэффициентом теплопроводности. Из
(4.13) и (4.14) следует, что выражение для
коэффициента теплопроводности имеет
вид:
![]() .
(4.15)
.
(4.15)
Рассмотрим
зависимость коэффициента теплопроводности
от давления и температуры. Из входящих
в (4.15) величин, только плотность
![]() и длина
свободного пробега
и длина
свободного пробега
![]() зависят от
давления, причем
зависят от
давления, причем
![]() и
и
![]() .
Это приводит к заключению, что коэффициент
теплопроводности не зависит от давления.
Этот вывод находится в превосходном
согласии с опытными данными, которые
показывают, что при изменении давления
в широких пределах коэффициент
теплопроводности остается постоянной.
.
Это приводит к заключению, что коэффициент
теплопроводности не зависит от давления.
Этот вывод находится в превосходном
согласии с опытными данными, которые
показывают, что при изменении давления
в широких пределах коэффициент
теплопроводности остается постоянной.
Из величин, входящих
в коэффициент теплопроводности (4.15),
только одна величина
зависит от температуры, причем
![]() ,
соответственно
,
соответственно
![]() .
.
Как показывает
опыт, коэффициент теплопроводности
растет с температурой несколько быстрее,
чем
![]() .
Это связано с тем, что коэффициент
теплопроводности зависит от длины
свободного пробега. Как показали раньше,
не является постоянной величиной, а
растет с температурой.
.
Это связано с тем, что коэффициент
теплопроводности зависит от длины
свободного пробега. Как показали раньше,
не является постоянной величиной, а
растет с температурой.
