
- •Лекция №1 Исторический экскурс
- •Лекция №2 Кинетическая теория газов
- •Изменение количества движения при ударе молекулы
- •Лекция №4 Поведение реальных газов и паров
- •Лекция №5 Длина свободного пробега молекул
- •Графически данное выражение представлено на рис.10
- •Примеры:
- •Лекция №6 Явление переноса
- •Лекция №7 Основы процесса откачки. Термины и определения.
- •Лекция №8. Средства получения вакуума.
- •Лекция №9 Вращательные насосы
- •Если мы разделим все выражение на р, то получим
- •Лекция №10 Жидкосно–кольцевые вакуумные насосы
- •Лекция №11 Двухроторные насосы (насосы Рутса)
- •Лекция №12 Диффузионные насосы
- •Лекция №13 Молекулярные насосы
- •Лекция №14 Сорбция газов и паров твердыми телами
- •Лекция №15 Адсорбционные насосы
- •Лекция №16 Геттерно – ионные насосы
- •Лекция № 17 Криогенные насосы (крионасосы)
- •Лекция №18 Принципы измерения вакуума
- •Лекция №19 Механические (деформационные) манометры
- •Лекция №20 Тепловые манометры
- •Лекция №21 Ионизационные манометры.
- •Лекция №22 Приборы для измерения парциальных давлений - масс-спектрометры
- •Лекция №23 Течеискание
- •Лекция №24 Конструкция рабочей камеры вакуумного оборудования.
- •Компоновка вакуумных технологических линий
- •Лекция №25 Структура компоновок многокамерного вакуумного технологического оборудования
- •Лекция 26 Элементы вакуумной арматуры
- •Фланец разъемный
- •Токоввод силовой
- •Термопарный ввод
- •Смотровые окна
- •Вводы вращения в вакуум
- •Вводы поступательного движения в вакуум
- •Конструкция внутреннего камерного устройства.
- •1. Газовыделение (десорбция) с внутренних поверхностей. Для ненагретых поверхностей:
- •2. Испарение. Поток газа, испаряемый с поверхностей легкоиспаряемых материалов (вакуумного масла, цинка, органических соединений, находящихся на поверхности) может быть найден по формуле:
- •Тогда поток испаряющегося масла:
- •3. Проницаемость. Поток газопроницаемости тонкостенного элемента по I-му газу (h2, He и т. Д.) может быть рассчитан по формуле
- •4. Натекание.
- •Лекция 28. Расчёт газовыделения из кинематических пар.
- •Пример 2: рассчитать газовыделение qк из шарикоподшипника серии 100 в вакууме при следующих параметрах:
- •4. Планетарно-винтовая передача.
- •Лекция №29 адсорбция и десорбция газов
- •Скорости адсорбции и десорбции
- •Лекция №30
- •4.1. Растворимость и газосодержание в твердых телах
- •Диффузия и проницаемость газов в твердых телах
- •Нестационарный процесс диффузии
- •Совместное влияние диффузии и адсорбции на газовыделение
Лекция №5 Длина свободного пробега молекул
Хотя молекулы газа, находящиеся в свободном состоянии, обладают большими скоростями движения, наблюдения показывают, что один газ диффундирует в другой очень медленно. Кинетическая теория газов объясняет это тем, что молекулы перемещаются в пространстве не по прямой линии, а по ломаной, в результате частых соударений. Термин “соударение ” естественно приводит нас к понятию “длина свободного пробега”.
Понятие “длина свободного пробега” может быть определено как расстояние, пробегаемое молекулой между двумя последовательными соударениями. Поскольку, величина этого расстояния есть функция скорости молекул, являющейся случайной величиной, мы приходим к необходимости использования вероятностного показателя “средняя длина свободного пробега ”,обозначаемая символом L, который определяется как среднее расстояние, проходимое молекулой между двумя последовательными соударениями.
Для вывода уравнения, определяющего “длину свободного пробега” молекулы удобно рассмотреть движение одной молекулы ( рис. 9) с диаметром dc

Рис.9
(dc=2dm, где dm –диаметр реальной молекул).В этом случае другие молекулы, с которыми соударяется “наша ” молекула, должны рассматриваться как материальные точки с диаметром d = 0. Тогда объем Vm, который вырезается при движении “нашей” молекулы в пространстве может быть рассчитан следующим образом:
![]()
где V – скорость молекулы
Рассчитаем число соударений К “нашей” молекулы с другими, которое определяется объемом газа Vm вырезаемым в секунду “нашей” молекулой из пространства:
![]() ,
,
где n – молекулярная концентрация, м –3.
Тогда,
![]() [соударений/с]
[соударений/с]
По определению длина свободного пробега может быть выражена:
![]() [м]
=
[м]
=
![]() [м]
[м]
В
нашей модели мы рассматривали “другие”
молекулы как фиксированные (неподвижные)
точки. Поскольку мы должны учитывать
движение других молекул, то необходимо
разделить полученное выражение на
![]() ,тогда
,тогда
![]()
Как показал Сюзерленд, действительный диаметр молекул уменьшается с увеличением температуры:
![]()
где С- постоянная Сюзерленда (С = 124 для воздуха, С = 90 для азота)
Тогда,

В повседневной практике удобно использовать следующее выражение (для воздуха, при температуре 200С), использующее параметр “давление” вместо параметра молекулярная концентрация:
L=![]() [м]
[м]
где р -давление воздуха, Па
Графически данное выражение представлено на рис.10
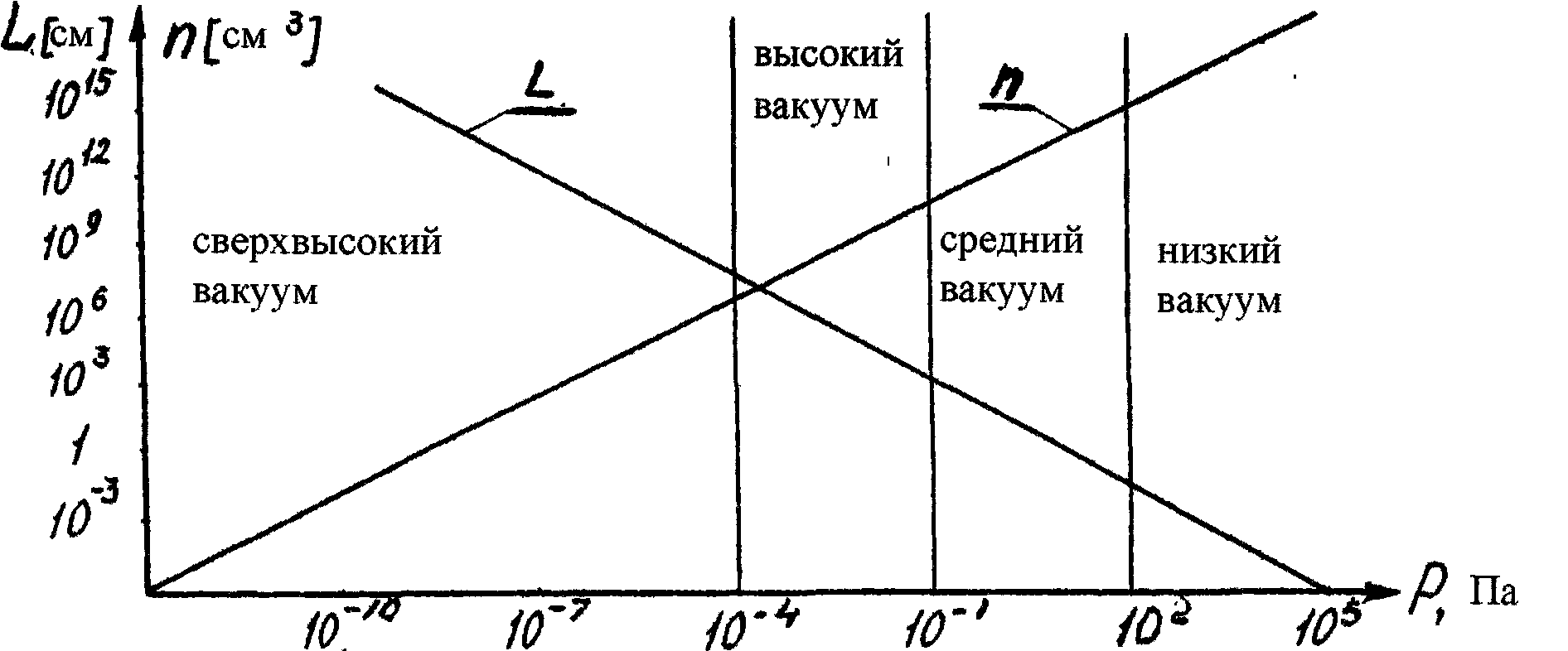
Рис.10
Число ударов молекул о стенку.
Мейером было показано, что число молекул ударяющихся о единицу поверхности в единицу времени определяются выражением:
N1
=![]() [1/м2с]
[1/м2с]
Проведённый объём газа, ударяющегося о единицу поверхности в единицу времени.
Объём газа V1 ударяющегося о единицу поверхности в единицу времени может быть выражен:
V1=![]() =
=![]() =
=![]() [
[![]() ]
]
V1=
[мc-1]
=
![]() =
=![]() [м3/м2с]
или V1=
[м3/м2с]
или V1=![]() [л*с-1 *см
-2]
[л*с-1 *см
-2]
