
- •Лекция №1 Исторический экскурс
- •Лекция №2 Кинетическая теория газов
- •Изменение количества движения при ударе молекулы
- •Лекция №4 Поведение реальных газов и паров
- •Лекция №5 Длина свободного пробега молекул
- •Графически данное выражение представлено на рис.10
- •Примеры:
- •Лекция №6 Явление переноса
- •Лекция №7 Основы процесса откачки. Термины и определения.
- •Лекция №8. Средства получения вакуума.
- •Лекция №9 Вращательные насосы
- •Если мы разделим все выражение на р, то получим
- •Лекция №10 Жидкосно–кольцевые вакуумные насосы
- •Лекция №11 Двухроторные насосы (насосы Рутса)
- •Лекция №12 Диффузионные насосы
- •Лекция №13 Молекулярные насосы
- •Лекция №14 Сорбция газов и паров твердыми телами
- •Лекция №15 Адсорбционные насосы
- •Лекция №16 Геттерно – ионные насосы
- •Лекция № 17 Криогенные насосы (крионасосы)
- •Лекция №18 Принципы измерения вакуума
- •Лекция №19 Механические (деформационные) манометры
- •Лекция №20 Тепловые манометры
- •Лекция №21 Ионизационные манометры.
- •Лекция №22 Приборы для измерения парциальных давлений - масс-спектрометры
- •Лекция №23 Течеискание
- •Лекция №24 Конструкция рабочей камеры вакуумного оборудования.
- •Компоновка вакуумных технологических линий
- •Лекция №25 Структура компоновок многокамерного вакуумного технологического оборудования
- •Лекция 26 Элементы вакуумной арматуры
- •Фланец разъемный
- •Токоввод силовой
- •Термопарный ввод
- •Смотровые окна
- •Вводы вращения в вакуум
- •Вводы поступательного движения в вакуум
- •Конструкция внутреннего камерного устройства.
- •1. Газовыделение (десорбция) с внутренних поверхностей. Для ненагретых поверхностей:
- •2. Испарение. Поток газа, испаряемый с поверхностей легкоиспаряемых материалов (вакуумного масла, цинка, органических соединений, находящихся на поверхности) может быть найден по формуле:
- •Тогда поток испаряющегося масла:
- •3. Проницаемость. Поток газопроницаемости тонкостенного элемента по I-му газу (h2, He и т. Д.) может быть рассчитан по формуле
- •4. Натекание.
- •Лекция 28. Расчёт газовыделения из кинематических пар.
- •Пример 2: рассчитать газовыделение qк из шарикоподшипника серии 100 в вакууме при следующих параметрах:
- •4. Планетарно-винтовая передача.
- •Лекция №29 адсорбция и десорбция газов
- •Скорости адсорбции и десорбции
- •Лекция №30
- •4.1. Растворимость и газосодержание в твердых телах
- •Диффузия и проницаемость газов в твердых телах
- •Нестационарный процесс диффузии
- •Совместное влияние диффузии и адсорбции на газовыделение
Лекция №4 Поведение реальных газов и паров
Газом называется вещество в газообразном состоянии при температуре выше критической.
Паром называется вещество в газообразном состоянии при температуре ниже критической.
Критическая температура (ТС) данного вещества – наибольшая температура, при которой это вещество может быть переведено из газообразного состояния (из пара) в жидкость путём сжатия.
Критическое давление (РС) – давление необходимое для превращения пара в жидкость при критической температуре.
Поведение газов не может быть корректно описано законом Бойля–Мариотта при температуре и давлении близких к критическим, но оно может быть вполне удовлетворительно описано уравнением Ван–дер–Ваальса:
![]()
где V – объём одного моля, м3;
a/V2 - добавка, учитывающая взаимодействия между молекулами;
b – слагаемое, учитывающее собственный объём молекул, м3
Диаграмма изотермического состояния вещества (на примере СО2) показана на рис.6,
где
Тс – критическая температура.
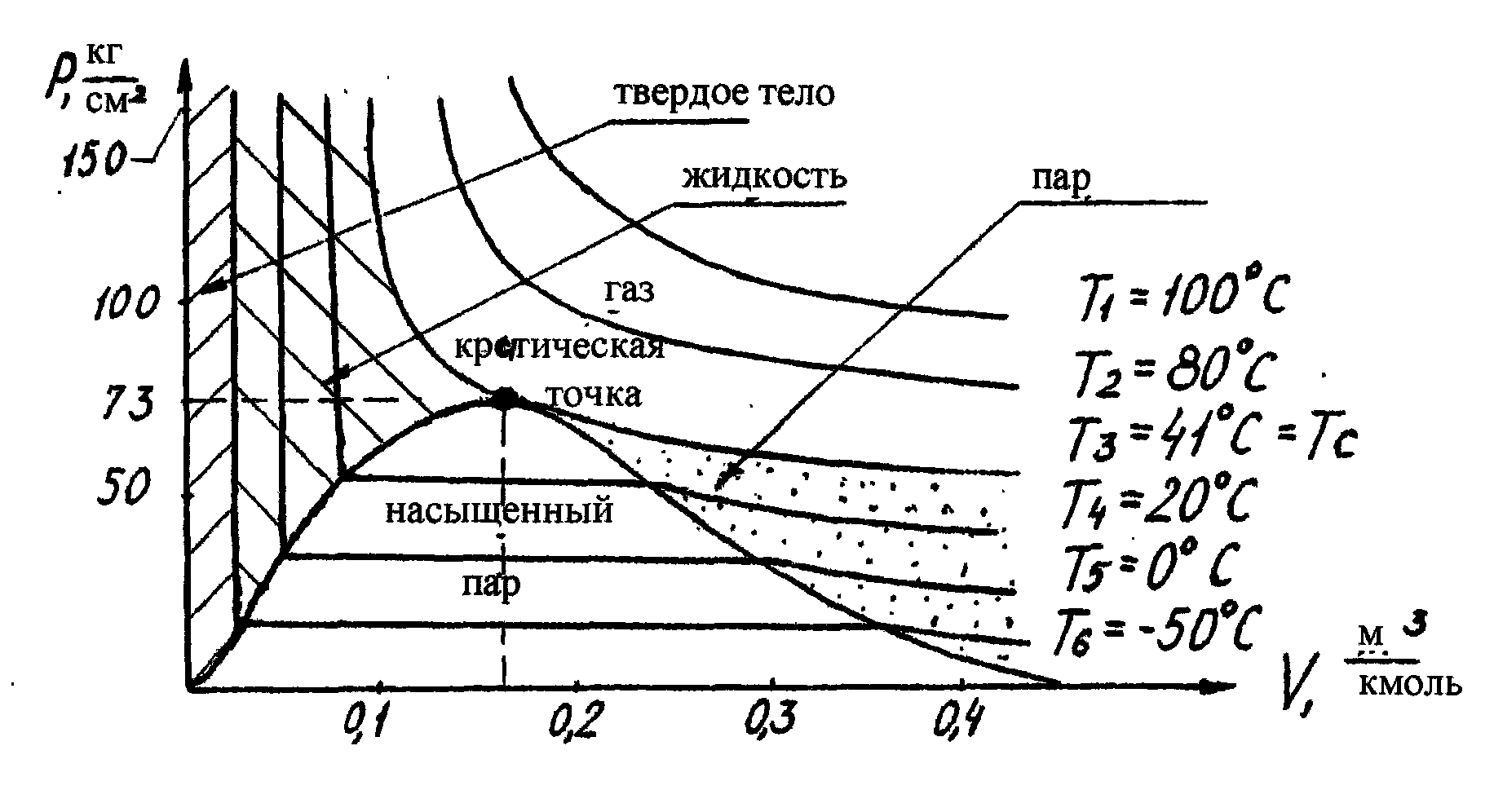
Рис.6
Коэффициенты уравнения Ван-дер-Вальса для некоторых атмосферных газов приведены в табл.1 Табл .1
Вещество |
TС , K |
PС, кг/см2 |
а,106кг*см4/ моль2 |
b, см3/моль |
Н2 |
33 |
12,8 |
0,24 |
26,5 |
Не |
5,3 |
2,2 |
3,25 |
23,4 |
Н2О |
647 |
217,5 |
5,47 |
30,5 |
N2 |
126 |
33,5 |
1,34 |
39,6 |
Поведение паров, при изменении температуры и давлении может быть проиллюстрировано диаграммой, представленной на рис.7, где стрелеками обозначены следующие процессы: а – испарение, b, d – конденсация, с – сублимация (испарение из твёрдой фазы).
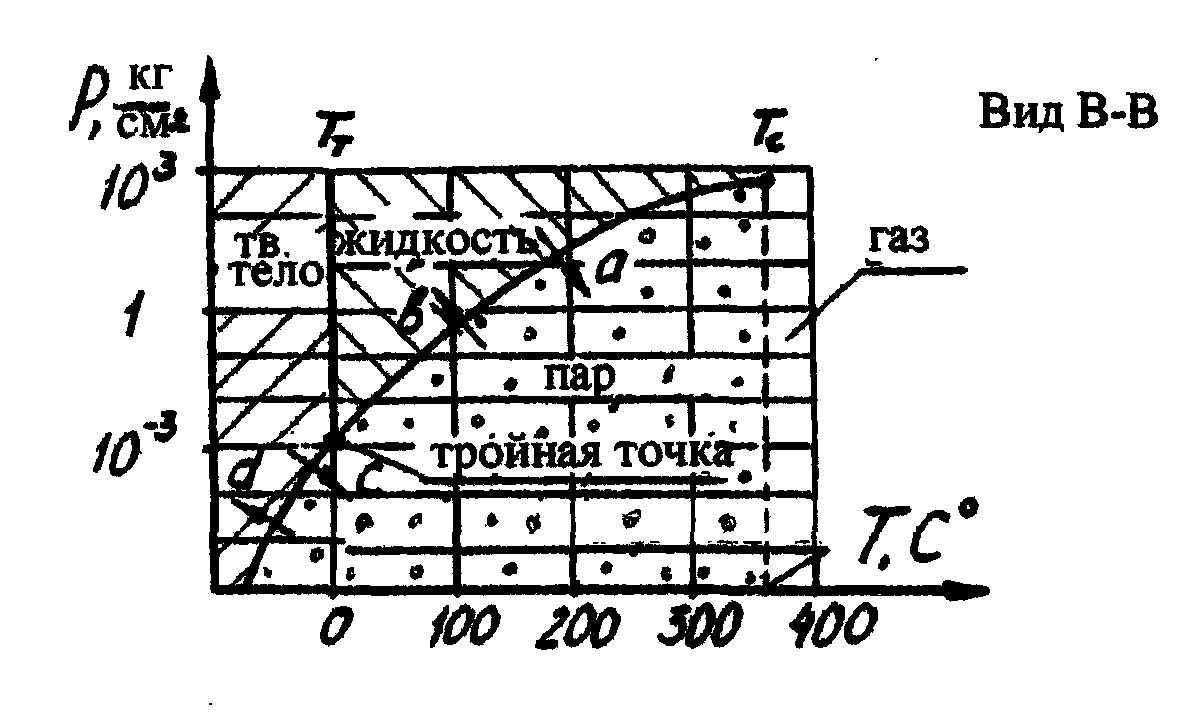
Рис.7, тройная диаграмма.
Эта диаграмма представляет вид В-В общей диаграммы состояния вещества, рис. 8
В соответствии с правилом Гиббса:
P+F=C+2,
где P – количество фаз,
F – количество степеней свободы,
C – количество компонентов.
Вещество в трёх фазах одновременно (жидкая, твёрдая, газообразная – паровая) может существовать только при одном характерном значении температуры и одном значении давлении, что на тройной диаграмме состояния вещества изображается так называемой «тройной точкой».
Две фазы: твёрдая и пар, либо жидкая и пар могут сосуществовать одновременно в равновесии при условиях, описываемых уравнением:
Lg P= A – B/T +CT + D lg T
где А, В ,С , D - коэффициенты для некоторых веществ, используемых в
вакуумной технике приведены в табл.2.
Т-температура, К
Р- давление насыщающих паров, Па.
Уравнение, описывающее двухфазное состояние вещества, в соответствии с законом Гиббса, представляет линию.
В таблице представлены коэффициенты уравнения, описывающего двухфазное состояние некоторых вакуумных материалов.
Табл . 2
Вещество |
A |
B |
C |
D |
P, тор |
Т, ОК |
Hg |
1216,0 |
9078 |
0,054 |
-82,87 |
1,2*10-3 |
293 |
Масло |
15,0 |
6000 |
--- |
--- |
|
293 |
Ga |
0,9 |
13425 |
0,0006 |
2,95 |
<10-8 |
293 |
Жидкость |
10,8 |
12295 |
0,00007 |
-0,082 |
<10-8 |
293 |
Тв.вещ-во |
470,0 |
26891 |
0,003 |
-179,0 |
<10-8 |
293 |
Все основные газовые законы могут быть сведены в одну трёхмерную (P, V, T) диаграмму, как это показано на рис. 8
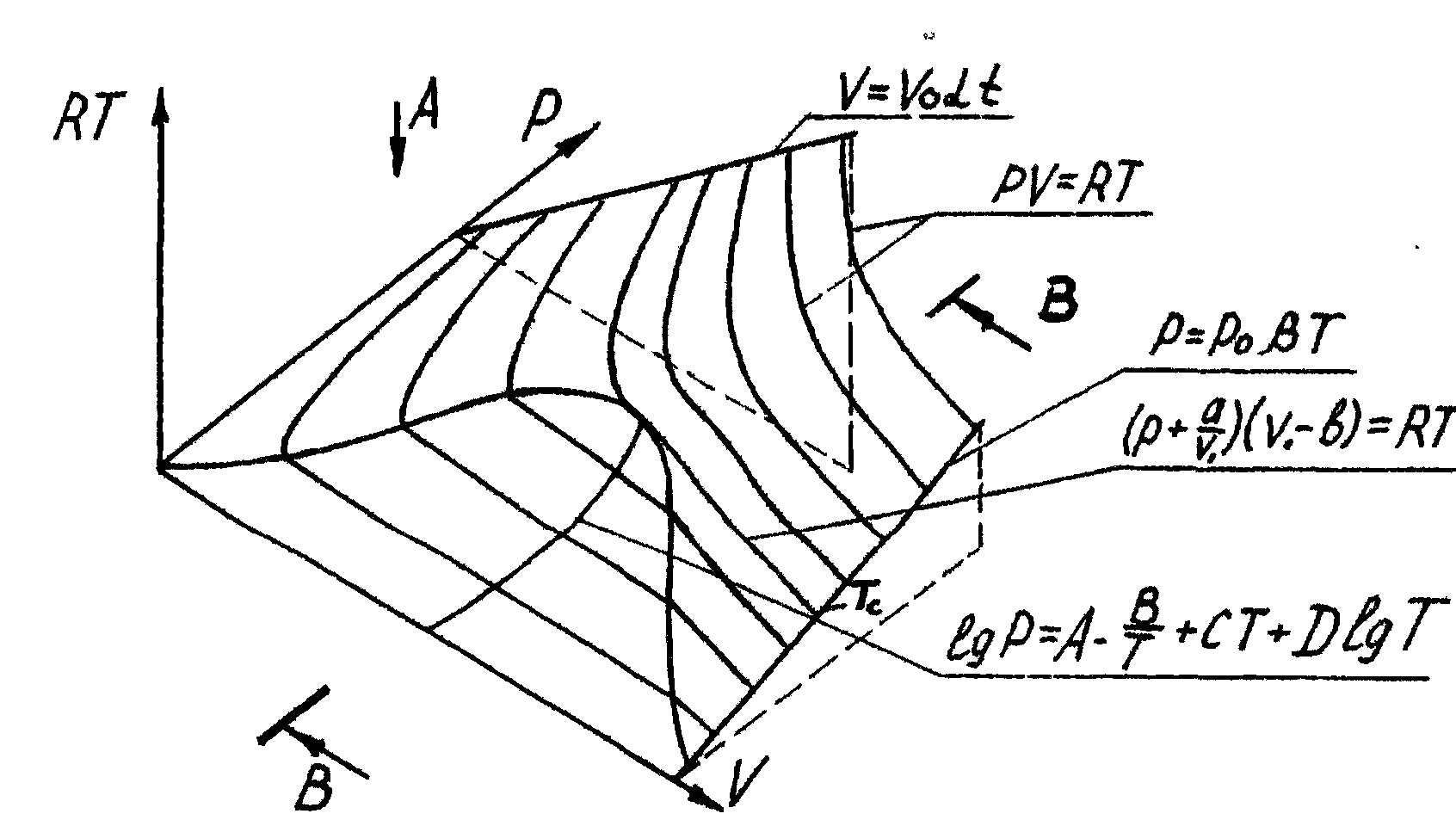
Рис.8
Выводы:
В замкнутом сосуде над поверхностью материала камеры всегда имеется насыщенный пар этого материала, давление которого может быть рассчитано с помощью диаграммы равновесного состояния вещества.
На практике абсолютный вакуум (т.е. давление меньшее, чем сумма давлений насыщающих паров веществ, из которых создана вакуумная камера) не достижим.
Чтобы обеспечить в системе высокий вакуум, поверхности вакуумной камеры обращённые в вакуум должны быть сделаны из материалов с малым давлением насыщающих паров.
Давление насыщающих паров жидкости в замкнутом объеме определяется температурой наиболее холодной стенки (т.к. пары конденсируются на наиболее холодной стенке) в соответствии с температурой которой устанавливается их давление.
