
- •Лекция №1 Исторический экскурс
- •Лекция №2 Кинетическая теория газов
- •Изменение количества движения при ударе молекулы
- •Лекция №4 Поведение реальных газов и паров
- •Лекция №5 Длина свободного пробега молекул
- •Графически данное выражение представлено на рис.10
- •Примеры:
- •Лекция №6 Явление переноса
- •Лекция №7 Основы процесса откачки. Термины и определения.
- •Лекция №8. Средства получения вакуума.
- •Лекция №9 Вращательные насосы
- •Если мы разделим все выражение на р, то получим
- •Лекция №10 Жидкосно–кольцевые вакуумные насосы
- •Лекция №11 Двухроторные насосы (насосы Рутса)
- •Лекция №12 Диффузионные насосы
- •Лекция №13 Молекулярные насосы
- •Лекция №14 Сорбция газов и паров твердыми телами
- •Лекция №15 Адсорбционные насосы
- •Лекция №16 Геттерно – ионные насосы
- •Лекция № 17 Криогенные насосы (крионасосы)
- •Лекция №18 Принципы измерения вакуума
- •Лекция №19 Механические (деформационные) манометры
- •Лекция №20 Тепловые манометры
- •Лекция №21 Ионизационные манометры.
- •Лекция №22 Приборы для измерения парциальных давлений - масс-спектрометры
- •Лекция №23 Течеискание
- •Лекция №24 Конструкция рабочей камеры вакуумного оборудования.
- •Компоновка вакуумных технологических линий
- •Лекция №25 Структура компоновок многокамерного вакуумного технологического оборудования
- •Лекция 26 Элементы вакуумной арматуры
- •Фланец разъемный
- •Токоввод силовой
- •Термопарный ввод
- •Смотровые окна
- •Вводы вращения в вакуум
- •Вводы поступательного движения в вакуум
- •Конструкция внутреннего камерного устройства.
- •1. Газовыделение (десорбция) с внутренних поверхностей. Для ненагретых поверхностей:
- •2. Испарение. Поток газа, испаряемый с поверхностей легкоиспаряемых материалов (вакуумного масла, цинка, органических соединений, находящихся на поверхности) может быть найден по формуле:
- •Тогда поток испаряющегося масла:
- •3. Проницаемость. Поток газопроницаемости тонкостенного элемента по I-му газу (h2, He и т. Д.) может быть рассчитан по формуле
- •4. Натекание.
- •Лекция 28. Расчёт газовыделения из кинематических пар.
- •Пример 2: рассчитать газовыделение qк из шарикоподшипника серии 100 в вакууме при следующих параметрах:
- •4. Планетарно-винтовая передача.
- •Лекция №29 адсорбция и десорбция газов
- •Скорости адсорбции и десорбции
- •Лекция №30
- •4.1. Растворимость и газосодержание в твердых телах
- •Диффузия и проницаемость газов в твердых телах
- •Нестационарный процесс диффузии
- •Совместное влияние диффузии и адсорбции на газовыделение
Лекция №14 Сорбция газов и паров твердыми телами
Одной из важнейших проблем вакуумной техники является удаление газов и паров, находящихся на поверхностях металлических, стеклянных, керамических деталей, обращенных внутрь вакуумной камеры.
Ряд специальных материалов, таких как активированный уголь, цеолиты, силикагель, с развитой поверхностью (за счет большого количества пар), могут поглощать этой поверхностью большие количества газов и поэтому используются как поглотители в специальных адсорбционных насосах.
Имеется несколько механизмов поглощения газов твердым телом:
Осаждение молекул газа и сорбция газа на поверхности (физическая адсорбция). Количество слоев адсорбированного газа (коэффициент покрытия Θ) может колебаться в широких пределах (Θ = 0,01 – 50, в зависимости от давления и температуры).
Растворение газов в твердом теле, подобно тому, как это происходит в жидкости
(физическая абсорбция).
Химическое взаимодействие твердого тела с газом (хемосорбция).
Во многих случаях газ, сорбированный поверхностью, может растворяться в твердом теле и, поэтому, трудно в чистом виде определить механизм поглощения. В этом случае употребим более общий термин сорбция (введенный МакБайном в 1909 г) включающий оба понятия: адсорбция и абсорбция . Твердое тело, поглощающее газ называется сорбентом, а осаждаемый газ – сорбатом (адсорбатом, абсорбетом). Процесс удаления сорбированного газа с поверхности называется десорбацией.
Сорбционная емкость сорбента определяется удельной поверхностью приходящейся на единицу массы.. Реальная поверхность:
F = S1*g,
где S1 – удельная поверхность, м2*г-1 ;
g - вес сорбента, г.
Сорбционная
емкость таких сорбентов, как активированный
уголь (S1![]() м2
*г-1(!)) , цеолиты (S1
м2
*г-1(!)) , цеолиты (S1![]() м2*
г-1), силикагель (S1
м2*
г-1) очень велика, по сравнению с
площадью поверхности таких материалов
как стекло, слюда, металл, для которых
площадь поверхности близка к геометрической.
м2*
г-1), силикагель (S1
м2*
г-1) очень велика, по сравнению с
площадью поверхности таких материалов
как стекло, слюда, металл, для которых
площадь поверхности близка к геометрической.
Физическая адсорбция увеличивается с уменьшением температуры, что связано с увеличением времени τ пребывания молекулы на поверхности в сорбированном состоянии. Количество молекул, сорбированных на единице поверхности может быть выражено:
n1s =N1*τ
где τ –
время сорбции, с (![]() при Т = 293 К)
при Т = 293 К)
N1 - число молекул, ударяющихся о единицу поверхности в единицу времени
N1 =n*Va/4 c-1м-2;
Энергия взаимодействия молекулы газа с поверхностью сорбата определяется потенциалом Леннарда – Джонса, который для взаимодействия двух отдельных молекул записываться:
U(d) = 4ε*[(r0/r)12-(r0/r)6]
где r – расстояние между центрам молекул,
ε* - минимальная потенциальная энергия взаимодействия,
r0 - расстояние, на котором потенциальная энергия обращается в нуль
Вандерваальсовские силы Fa межмолекулярного притяжения пропорциональны r-6,
силы отталкивания Fr , возникающие при сближении электронных оболочек пропорциональны r –12, рис.31.
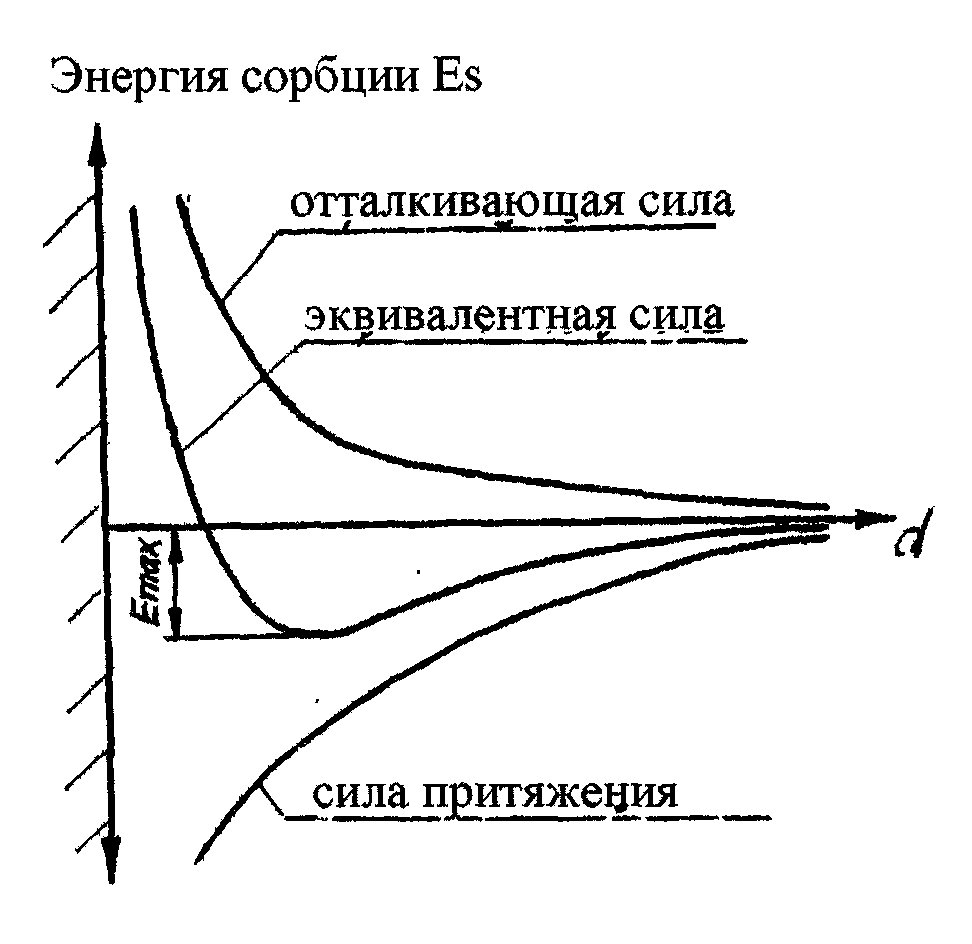
Рис.31
Максимальная энергия притяжения U(d)max – т.е. энергия в так называемой “энергетической яме” соответствует расстоянию d, на котором находятся взаимодействующие молекулы . Энергия взаимодействия молекулы сорбата со всеми молекулами, образующими поверхность запишется:
U(d) = (π/3)N ε* r03 [(r0/r)3-(1/15)(r0/r)9]
где N – число молекул в единцу объема твердого тела.
Условием прочного удержания сорбированной молекулы на поверхности является
U(d)max> (3/2)*kT ,
где k – постоянная Больцмана;
T – температура молекулы.
т.е. условие не превышения уровня тепловой энергии молекулы (3/2 kТ) над уровнем максимальной энергии сорбции U(d)max.
В зависимости от вида поверхности(плоская поверхность, поры, щели) и от характера взаимодействия существуют выражения (изотермы адсорбции), позволяющие определять количество сорбированного на поверхности газа или пара при данной температуре.
Закон Генри, рис. 32, представляет прямопропорциональную зависимость количества сорбированного газа G от давления газа P над поверхностью (закон описывает поведение сорбата при низких давлениях газов). Количество сорбированного газа выражается через коэффициент покрытия Θ (количество монослоев сорбата на поверхности):
Θ =G/Gm= b*P
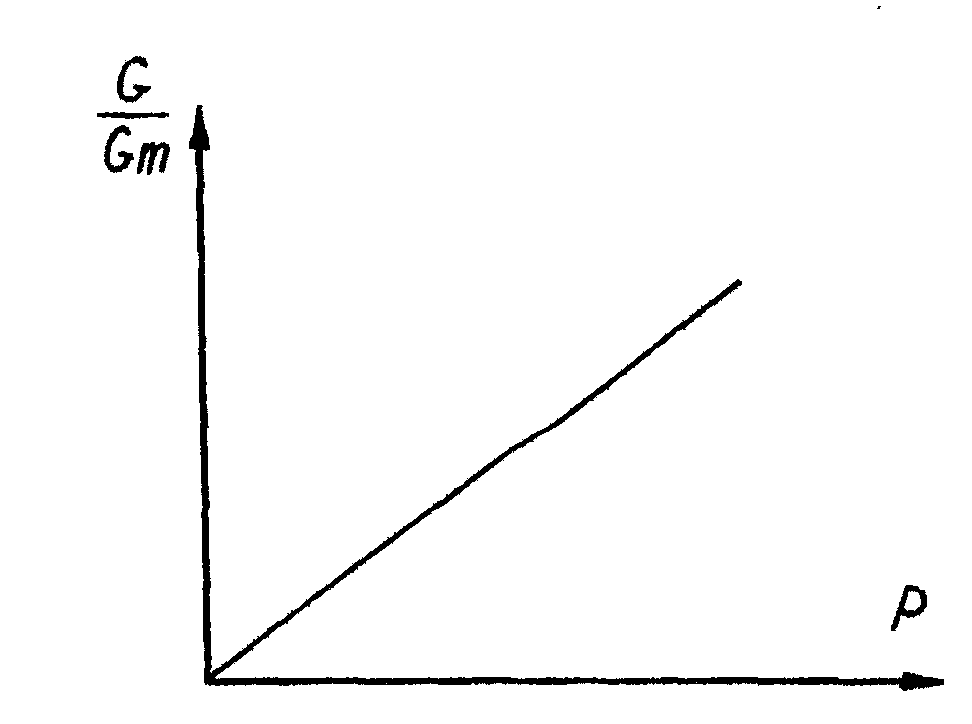
Рис.32
где Gm - количество газа в одном монослое, м3*Па*м -2
G – количество сорбированного газа, м3*Па*м -2
b – коэффициент Генри, характеризующий емкость сорбата при данной
температуре, Па –1
![]()
где α – коэффициент прилипания;
N1П - количество “мест” на единице площади поверхности;
m - масса молекулы;
T - температура сорбента
Уравнение Ленгмюра, рис. 33, описывает поведение сорбата (вплоть до образования монослоя) в более широком диапазоне давлений
Θ
=G/Gm=
![]()
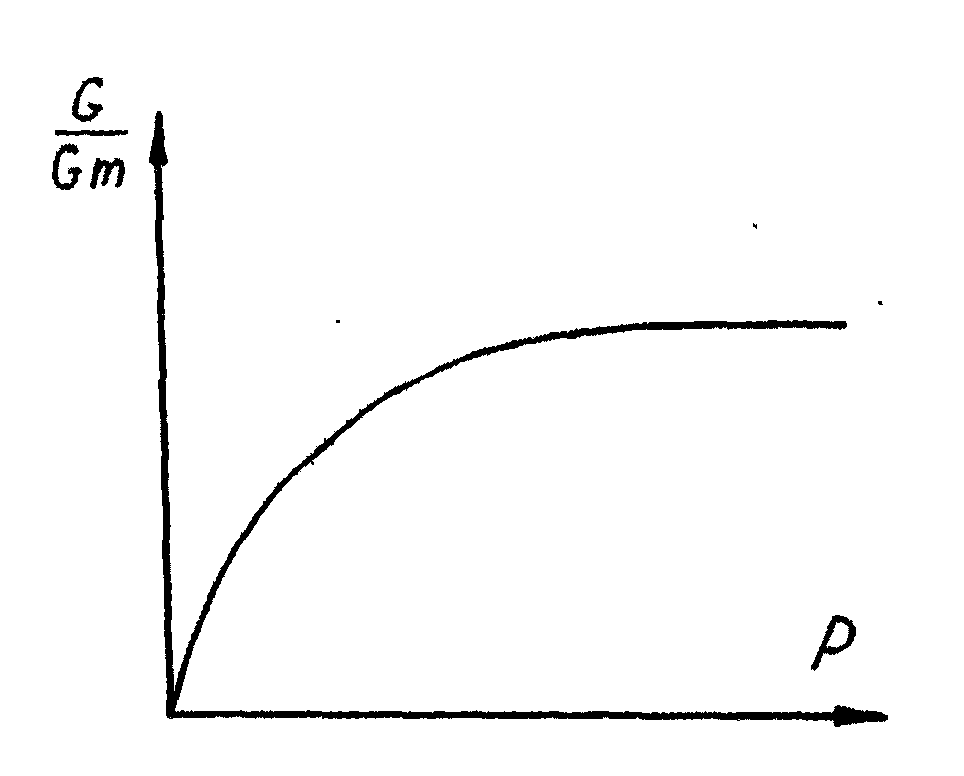
Рис.33
Коэффициент Генри в уравнениях Генри и Ленгмюра может быть выражен в размерности представляющей объем сорбата, сорбируемого на 1 грамме сорбента.
В этом случае уравнение Генри будет выглядеть так: G = PV = HTPGS
где G = PV – общее количество газа, сорбированное на сорбенте, м3*Па
HT – значение коэффициента Генри при данной температуре, м3*г-1
P - давление газа над сорбентом, Па
GS – все сорбента, г
Ниже приводятся значения коэффициентов Генри для разных сорбентов при комнатной температуре 293 К и температуре жидкого азота 77К.
Сорбент Коэф. Генри |
Уголь активир. СКТ |
Цеолит СаА |
Цеолит Ag X |
H 293, м3*г-1 |
10-4 |
2,5*10-3 |
3*10-2 |
H 77, м3*г-1 |
16 |
5,6 |
5 |
Уравнение полимолекулярной адсорбции
(Уравнение Бруннауэра - Эммета – Теллера или уравнение БЭТ) описывающее поведение сорбата при давлениях, вплоть до давления насыщающих паров сорбата

где ES - энергия сорбции газа на сорбенте (т.е. энергия сорбции первого
монослоя, Дж*моль-1)
EL - теплота парообразования сорбата (т.е. энергия сорбции второго и
последующих слоев на предидущих слоях сорбата ) Дж*моль-1
P - давление газа (пара) над сорбентом, Па
PL - давление насыщающих паров сорбата, Па
R - универсальная газовая постоянная R = 8,34*103 Дж*моль-1
T - температура поверхности, К
Данное уравнение показывает, что первый слой сорбата сорбирован очень прочно, т.к. связан с сорбентом энергией ES , которая больше ,чем энергия ELm – связывающая последующие монослои сорбата.
