
- •Лекция №1 Исторический экскурс
- •Лекция №2 Кинетическая теория газов
- •Изменение количества движения при ударе молекулы
- •Лекция №4 Поведение реальных газов и паров
- •Лекция №5 Длина свободного пробега молекул
- •Графически данное выражение представлено на рис.10
- •Примеры:
- •Лекция №6 Явление переноса
- •Лекция №7 Основы процесса откачки. Термины и определения.
- •Лекция №8. Средства получения вакуума.
- •Лекция №9 Вращательные насосы
- •Если мы разделим все выражение на р, то получим
- •Лекция №10 Жидкосно–кольцевые вакуумные насосы
- •Лекция №11 Двухроторные насосы (насосы Рутса)
- •Лекция №12 Диффузионные насосы
- •Лекция №13 Молекулярные насосы
- •Лекция №14 Сорбция газов и паров твердыми телами
- •Лекция №15 Адсорбционные насосы
- •Лекция №16 Геттерно – ионные насосы
- •Лекция № 17 Криогенные насосы (крионасосы)
- •Лекция №18 Принципы измерения вакуума
- •Лекция №19 Механические (деформационные) манометры
- •Лекция №20 Тепловые манометры
- •Лекция №21 Ионизационные манометры.
- •Лекция №22 Приборы для измерения парциальных давлений - масс-спектрометры
- •Лекция №23 Течеискание
- •Лекция №24 Конструкция рабочей камеры вакуумного оборудования.
- •Компоновка вакуумных технологических линий
- •Лекция №25 Структура компоновок многокамерного вакуумного технологического оборудования
- •Лекция 26 Элементы вакуумной арматуры
- •Фланец разъемный
- •Токоввод силовой
- •Термопарный ввод
- •Смотровые окна
- •Вводы вращения в вакуум
- •Вводы поступательного движения в вакуум
- •Конструкция внутреннего камерного устройства.
- •1. Газовыделение (десорбция) с внутренних поверхностей. Для ненагретых поверхностей:
- •2. Испарение. Поток газа, испаряемый с поверхностей легкоиспаряемых материалов (вакуумного масла, цинка, органических соединений, находящихся на поверхности) может быть найден по формуле:
- •Тогда поток испаряющегося масла:
- •3. Проницаемость. Поток газопроницаемости тонкостенного элемента по I-му газу (h2, He и т. Д.) может быть рассчитан по формуле
- •4. Натекание.
- •Лекция 28. Расчёт газовыделения из кинематических пар.
- •Пример 2: рассчитать газовыделение qк из шарикоподшипника серии 100 в вакууме при следующих параметрах:
- •4. Планетарно-винтовая передача.
- •Лекция №29 адсорбция и десорбция газов
- •Скорости адсорбции и десорбции
- •Лекция №30
- •4.1. Растворимость и газосодержание в твердых телах
- •Диффузия и проницаемость газов в твердых телах
- •Нестационарный процесс диффузии
- •Совместное влияние диффузии и адсорбции на газовыделение
4. Планетарно-винтовая передача.
 Рис.
4 Схема контактного взаимодействия в
планетарно-винтовой передаче
Рис.
4 Схема контактного взаимодействия в
планетарно-винтовой передаче


Лекция №29 адсорбция и десорбция газов
В зависимости от характера взаимодействия газов с поверхностью твердого тела различают физическую и химическую адсорбцию (хемосорбцию).
При физической адсорбции энергия связи молекул газа с поверхностью большинства материалов сравнительно невелика (до 4*104 Дж/моль), а характер взаимодействии определяется силами Ван-дер-Ваальса.
Процесс хемосорбции подобен образованию химического соединения. Энергия связи при этом может составлять 106 Дж/моль, а сам процесс в отличие от физической адсорбции нередко бывает необратим.
Заметим, что часто оба процесса адсорбции протекают одновременно. Характеризовать адсорбцию можно числом поглощенных поверхностью молекул или объемом поглощенного газа.
При
рассмотрении физической адсорбции
количество поглощенного газа обычно
относят к единице поверхности твердого
тела. Если вакантные места заняты
молекулами, то говорят, что заполнение
поверхности твердого тела равно одному
монослою. Заполнение поверхности
адсорбированным газом можно характеризовать
коэффициентом покрытия
![]() .
.
![]() ;
(1)
;
(1)
где
Nпов
–
количество молекул, адсорбированных
на границе поверхности твердого тела;
N1пов
–
число мест на единице поверхности,
которые могут быть заняты адсорбированными
молекулами (число молекул в заполненном
мономолекулярном слое). Число молекул
N1пов
рассчитывают, полагая что молекулы газа
покрывают поверхность тела с шагом,
равным их диаметру
![]() (см. приложение 1). При этом получаются
значения от 0,4*1019
до
2,5*1019
м-2
(табл. 1). Обычно при ориентировочных
расчетах принимают
(см. приложение 1). При этом получаются
значения от 0,4*1019
до
2,5*1019
м-2
(табл. 1). Обычно при ориентировочных
расчетах принимают
![]() ;
(2)
;
(2)
Таблица 1.
Теоретические значения числа молекул в молекулярном слое газа Nпов на 1м2 поверхности
Газ |
He |
Ne |
H2 |
O2 |
Ar |
N |
CO |
CO2 |
H2O |
|
2.42 |
1.72 |
1.52 |
0.87 |
0.85 |
0.81 |
0.81 |
0.53 |
0.53 |
Количество газа Q1*102 на 1м2 поверхности при Т300К в pV-единицах, м2*Па |
9,76 |
6,94 |
6,14 |
3,51 |
3,43 |
3,27 |
3,27 |
2,14 |
2,14 |
П
р и м е ч а н и е : Количество газа на 1м2
поверхности в pV-единицах
будет равно:
![]()
Фактическая поверхность адсорбента не всегда поддается измерению и нередко неизвестна. Поэтому часто количество адсорбированного газа относят к 1 кг адсорбента или другой единице массы.
В случае, когда покрытие превышает одни монослой, процесс адсорбции начинает напоминать конденсацию, а энергия связи уменьшается и начинает приближаться к теплоте испарения. При заполнении поверхности твердого тела, существенно меньше одного монослой, можно считать количество адсорбированного газа Q пропорциональным давлению p, так как условия поглощения молекул газа поверхностью твердого тела не будут зависеть от заполнения. Для описания процесса адсорбции в этом случае Фрейндлихом предложена эмпирическая формула
![]() ; (3)
; (3)
где kф и nф - постоянные, зависящие от природы адсорбента и адсорбируемого газа. Уравнение (3) обычно записывают в логарифмической форме:
![]() ;
(4)
;
(4)
и тогда в логарифмических координатах оно описывается прямой линией, тангенс угла наклона которой равен 1/nф. При nф=1 между количеством поглощенного газа и давлением существует прямая пропорциональность, аналогичная закону Генри для растворов.
Кривые V=f(р), снятые при постоянной температуре, представляют собой изотермы адсорбции.
Уравнение (4) описывает адсорбцию инертных газов и окиси углерода на угле, водорода на порошке вольфрама при небольших давлениях и соответственно малых заполнениях поверхности.
В стационарном состоянии число адсорбирующихся атомов или молекул должно быть равно числу десорбирующихся:
![]() ;
(5)
;
(5)
где - коэффициент прилипания, характеризующий долю адсорбирующихся молекул на поверхности твердого тела; Nu - число молекул, ударяющихся о единицу поверхности [см. уравнение (8)]; - число молекул, десорбирующихся в единицу времени с единицы поверхности.
Уравнение (5) можно записать в несколько иной форме. Тогда скорость изменения числа адсорбированных на поверхности молекул равна:
![]() .
(6)
.
(6)
В предположении, что адсорбированные молекулы не взаимодействуют между собой, можно считать количество десорбирующихся молекул пропорциональным количеству адсорбированных:
![]() (7)
(7)
где 1 - число молекул, десорбирующихся при полностью покрытой молекулами газа поверхности; - коэффициент заполнения поверхности молекулами адсорбированного газа.
Число десорбирующихся с поверхности молекул, очевидно, должно быть обратно пропорционально времени их пребывания в адсорбированном состоянии на поверхности твердого тела, и, таким образом, вместо уравнения (7) можно записать:
 (8)
(8)
где ts - время пребывания молекулы на поверхности в адсорбированном состоянии. Френкелем было предложено следующее выражение для ts:
![]() (9)
(9)
где 0 - коэффициент, связанный с периодом колебаний атомов на поверхности адсорбента; Едес - энергия десорбции; Т - температура поверхности; R0 - газовая постоянная.
Коэффициент 0 может меняться в довольно широких пределах в зависимости от свойств материала и газа. Так, например, для инертных газов на графите 0 = (7-10)*10-13 с, на стекле 02*10-14 с, для атомарного кислорода на вольфраме 0 = 8*10-14 с, а для атомарного водорода 0=5*10-14 с. В расчетах обычно принимают 0=10-13 с.
Количество адсорбирующихся молекул можно считать пропорциональным доле поверхности, не заполненной газом:
![]() (10)
(10)
В этом случае уравнение (6) запишется в виде
 (11)
(11)
и после преобразования
 (12)
(12)
Если использовать формулы приведенными в предыдущих лекциях, то после подстановки и преобразований получим:
 (13)
(13)
где

Уравнение (12) описывает гиперболическую изотерму адсорбции Ленгмюра. Значения коэффициента b в уравнении (1З) для ряда систем <газ - металл>, применимых при внешних давлениях меньше 102 Па, приведены отдельно.
При весьма малых давлениях уравнение (12) имеет вид:
![]() (14)
(14)
т. е. аналогично закону Генри.
В случае, если при адсорбции происходит диссоциация молекул на атомы, для двухатомных газов вместо (10) получим:
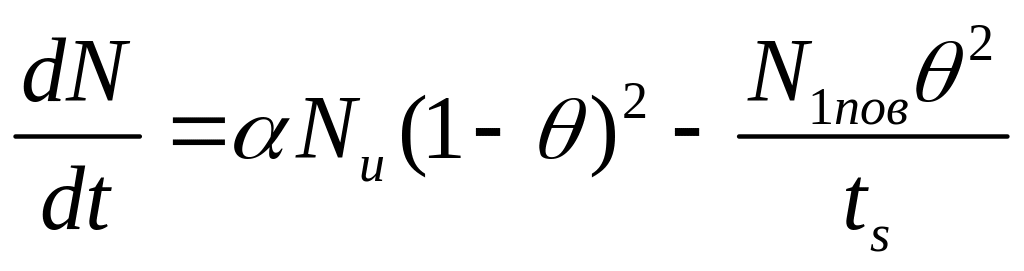 (15)
(15)
так как для адсорбции молекулы на поверхности должны быть свободны две площадки, а для осуществления десорбции на соседних площадках должны быть два атома. В результате для сорбции двухатомного газа в атомарном состоянии имеем:
 (16)
(16)
Для трехатомного газа в формуле (13) вместо квадратного корня должен быть кубический корень. В общем виде можно записать:
 (17)
(17)
Таким образом, уравнение Ленгмюра описывает адсорбцию, в том числе хемосорбцию, в достаточно широком диапазоне давлений. Вместе с тем имеются экспериментальные данные, указывающие на наличие полимолекулярной адсорбции даже при малых значениях коэффициента заполнения . Применительно к полимолекулярной адсорбции выведено уравнение Брунауеpa - Эмметта - Теллера (БЭТ), объясняющее ход изотерм адсорбции различного вида, записываемое обычно в следующей форме:
 (18)
(18)
где Еад - энергия адсорбции моля газа; Екон - энергия конденсации моля газа; рнас - давление насыщенных паров адсорбируемого вещества при температуре Т.
Отметим, что полимолекулярная адсорбция наблюдается лишь при сравнительно высоких давлениях и значительных энергиях адсорбции.
При низких давлениях, обычно достигаемых в вакуумных системах, уравнение БЭТ сводится к уравнению Ленгмюра, которое мы и будем в основном использовать.
При инженерных расчетах гораздо удобнее вместо количества молекул, с которыми оперируют в уравнениях (10) и (11), использовать значения участвующего в процессах адсорбции газа в рV-единицах. При этом удельные потоки адсорбирующегося и десорбирующегося газа могут быть определены по формулам:
![]() (19)
(19)
где - коэффициент прилипания; Nu - число молекул, ударяющихся о единицу поверхности; Т - абсолютная температура;
![]() (20)
(20)
где N1пов - количество мест на единичной поверхности, которые могут быть заняты адсорбированными молекулами; ls - время пребывания молекулы в адсорбированном состоянии; - коэффициент заполнения.
