
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Естери і жири
|
Естери |
Жири |
|
Естери можна
розглядати як похідні кислот, у яких
Гідроген гідроксильної групи заміщений
на вуглеводневий радикал спирту.
Назви
естерів утворюються від назв відповідних
кислот і спиртів з додаванням слова
естер. Наприклад, естер
|
Жири —
це естери, утворені вищими одноосновними
карбоновими кислотами й триатомним
спиртом гліцерином. Загальна назва
таких сполук — тригліцериди.
Природні жири — суміш різних
тригліцеридів.
Загальна
формула тригліцеридів:
|
|
Фізичні властивості естерів. Естери нижчих карбонових кислот і спиртів — леткі рідини, малорозчинні або нерозчинні у воді, добре розчинні у спирті та інших органічних розчинниках. Багато естерів мають приємний запах. Естери вищих кислот і спиртів — воскоподібні речовини, без запаху, нерозчинні у воді, добре розчинні в органічних розчинниках. |
Фізичні властивості жирів. За кімнатної температури жири бувають рідкими й твердими. Агрегатний стан жирів визначається жирними кислотами, які входять до їхнього складу. Тверді жири утворені насиченими кислотами, рідкі жири (олії) — ненасиченими. Температура плавлення жиру тим вища, чим більше в ньому насичених кислот і чим довший кислотний радикал. Тваринні жири частіше тверді, рослинні частіше рідкі. Жири розчинні в органічних розчинниках і нерозчинні у воді. Біологічне значення жирів. Жири входять до складу клітин рослинних і тваринних організмів, є джерелом енергії в клітині, будівельним матеріалом, беруть участь в обміні речовин, відкладаються в тканинах організму як запасна поживна речовина. |
|
Застосування естерів. Складні естери застосовуються як розчинники та розріджувачі для лаків і фарб, як ароматизатори в харчовій промисловості |
Застосування жирів. Жири застосовуються в харчовій промисловості, в косметології, для добування гліцерину і вищих карбонових кислот. |
Отримання і хімічні властивості естерів
Отримання
1. Етерифікація за Фішером (взаємодія спиртів і карбонових кислот у присутності сильних неорганічних кислот, наприклад, сульфатної кислоти)
C2H5OH + CH3COOH = CH3COOC2H5
Дана реакція є зворотною і умови її протікання залежать від природи вихідних речовин.
Хімічні властивості
1. Кислотний гідроліз
CH3COOC2H5= C2H5OH + CH3COOH
2. Лужний гідроліз
CH3COOC2H5 + NaOH = C2H5OH + CH3COONa
На відміну від кислотного лужний гідроліз естерів протікає незворотно
Отримання і хімічні властивості жирів
Отримання
Жири отримують з продуктів рослинного або тваринного походження.
Хімічні властивості
1. Гідроліз (омилення) жирів у лужному середовищі

*Жир обробили лугом, отриманий при цьому спирт відділили і прокип’ятили із сумішшю оцтової і сульфатної кислоти. Напишіть рівняння і назви реакцій. Обчисліть, скільки грамів кінцевого продукту може бути отримано з 680гр. жиру, якщо вихід на обох стадіях реакцій дорівнює 98%.
*Напишіть рівняння реакцій, за допомогою яких можливо здійснити запропоновані перетворення:
*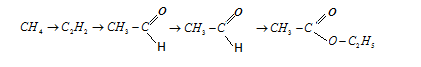

*формальдегід → метанова кислота → пентилметаноат → пентанол → пентаналь ↓ форміат натрію
*карбід кальцію → ацетилен → етаналь → етанова кислота → етаноат магнію → етаноат натрію.
*Складіть і назвіть два різнотипових ізомери до сполуки: метил-2,2-диметилпропаноат.
*Яку масу жиру, що містить 81% тристеарату гліцерину (решта не гліцериди) треба взяти для синтезу 45,4 г нітрогліцерину за умови, що всі перетворення протікають кількісно?
*Обчисліть кількість вільних жирних кислот в одному грамі жиру, якщо на нейтралізацію його наважки масою 0,25 г витрачено 0,56 г 1%-ного розчину гідроксиду калію. Як присутність вільних жирних кислот впливає на якість жиру?
*Яка маса естеру утвориться в результаті взаємодії 50 г мурашиної кислоти з 50 г етилового спирту?
*Яку масу етилового естеру оцтової кислоти можна добути з 120 г оцтової кислоти і 92 г спирту, якщо масова частка практичного виходу естеру становить 90% від теоретично можливого?
*Для гідролізу 35 г тригліцериду витрачено 66,2 мл 20%-ного за масою розчину гідроксиду натрію (ρ=1,22 г/мл). Визначте будову тригліцериду.
*Яку масу триолеїноалеату та об\'єм водню потрібно для утворення відповідного твердого жиру масою 801 кг?
*Трипальмітиноат піддали гідролізу в присутності надлишку натрій гідроксиду. Які продукти реакції утворилися і яка їх маса, якщо гідролізував жир масою 201,5 кг?


 де
де
 називається тригліцерид
стеаринової кислоти,або тристеарин.
називається тригліцерид
стеаринової кислоти,або тристеарин.