- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Оксиди і гідроксиди Феруму
Ферум утворює три оксиди і два гідроксиди:

Оксиди і гідроксиди Феруму обох ступенів окиснення мають амфотерні властивості. У сполук Феруму(ІІ) вони дуже слабко виражені, тому ферум(ІІ) оксид і ферум(ІІ) гідроксид виявляють переважно основні властивості:
1)взаємодія з кислотами
*допишіть рівняння відповідних реакцій
FeO + 2HCl =
Fe(OH)2 + H2SO4 =
2)Ферум(ІІ) оксид з лугами не взаємодіє.
3)Ферум(ІІ) гідроксид, якщо він свіжодобутий і під час кип’ятіння реагує з концентрованим розчином лугу:
Fe(OH)2 + 2NaOH = Na2[Fe(OH)4]
Натрійтетрагідроксиферат(ІІ)
Ферум(ІІ) гідроксидутворюєтьсявнаслідокдіїлугівнарозчинисолейФеруму(ІІ):
![]()
Саме так відбувається реакція без доступу повітря. У протилежному разі ферум(ІІ) гідроксид легко окиснюється до ферум(ІІІ) гідроксиду:
![]()
Сполуки Феруму(ііі).
Оксид і гідроксид Феруму(ІІІ) мають більш виражені амфотерні властивості:
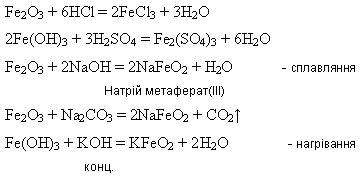
Посилення кислотних властивостей сполук Феруму(ІІІ) порівняно із сполуками Феруму(ІІ) пояснюється збільшенням ковалентності зв’язку Fe – O із підвищенням ступеня окиснення Феруму.
Ферум(ІІІ) оксид утворюється внаслідок дії лугів на розчини солей Феруму(ІІІ):
![]()
Гідроксиди Феруму(ІІ) і (ІІІ) під час нагрівання розкладаються:
2Fe(OH)3 = Fe2O3 + 3H2O
Fe(OH)2 = FeO + H2O
Подвійний (змішаний) оксид.
Підчасвзаємодіїзкислотамиутворюєсумішдвохсолей – Феруму(ІІ) іФеруму(ІІІ):
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 4H2SO4 = Fe2(SO4)3 + FeSO4 + 4H2O
Підчасвзаємодіїзнітратноюкислотоюутворюєтьсялишеоднасіль – ферум(ІІІ) нітратвнаслідококисненнясполукФеруму(ІІ) досполукФеруму(ІІІ):

Якісні реакції на солі Феруму(ІІ) і Феруму(ІІІ)
Реактивом на йони Феруму(ІІ) є червона кров’яна сіль K3[Fe(CN)6 ] - калій гексаціаноферат(ІІІ), яка під час взаємодії з солями Феруму(ІІ) дає осад синього кольору – турнбулеву синь:

Реактивом на йони Феруму(ІІІ) є жовта кров’яна сіль K4[Fe(CN)6] - калій гексаціаноферат(ІІ), яка під час взаємодії з солями Феруму(ІІІ) дає осад синього кольору – берлінську лазур:

Іншим реактивом на йони Феруму(ІІІ) є амоній тіоціанат NH4SCN або калій тіоціанат KSCN. Утворюється сполука темно-червоного кольору:
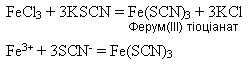
*Напишіть рівняння можливих реакцій між:
1)ферумом і карбоном
2)ферумом і купрум хлоридом
3)оксидом феруму(2) і хлоридною кислотою
4)оксидом феруму (3) і натрій гідроксидом
5)гідроксидом феруму (2) і фосфатною кислотою
6)гідроксидом феруму (3) і сульфатною кислотою
*здійсніть претворення
Fe2O3 → Fe → FeCl2 → Fe(OH)2 → FeO → Fe → FeCl3
Органічна хімія
|
Вуглеводні *напишіть гомологічний ряд алканів,алкенів,алкінів *пригадайте що таке ізомерія та ізомери. *напишіть по 3 ізомери гексану,гептену,ноніну.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
*дайте назву сполукам:
*запишіть за назвами формулу сполук: а)3,3-диметил-4-етилгептан б)4,4,6-триметил-3,5-диетилнонен-1 Отримання алканів
Промислові методи 1. У промислових умовах насичені вуглеводні з довжиною ланцюга до одинадцяти атомів Карбону отримують звичайно наступними методами: • фракційна перегонка нафти; • переробка природного газу; • гідрогенізація вугілля:
2. Синтез Фішера – Тропша
Лабораторні методи 1. Гідроліз карбіду алюмінію Al4C3 +12H2O → 4Al(OH)3+3CH4 2. Декарбоксилювання
Синтез Вюрца 2СН3Сl+2Na → C2H6+2NaCl; 2R-Br+2Na → R-R+2NaBr 3. Гідрування (гідрогенізація) алкенів
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||