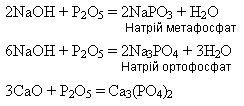- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Хімічні властивості.
Нітроген(ІІ) оксид на повітрі легко окиснюється і переходить у бурий газ:
2NO + O2 = 2NO2
Нітроген(ІІІ) оксид взаємодіє з водою з утворенням нітритної кислоти:
N2O3 + H2O = 2HNO2
Нітроген(IV)оксид (бурий газ) взаємодіє з водою з утворенням двох кислот – нітратної і нітритної:
2NO2 + H2O = HNO3 + HNO2
За наявності надлишку кисню у воді утворюється тільки нітратна кислота:
![]()
Бурий газ, що міститься у відхідних газах („лисячий хвіст”), шкідливих для всього живого, тепер розкладають за допомогою каталізатора:
![]()
Нітроген(V) оксид взаємодіє з водою з утворенням нітратної кислоти:
![]()
*визначте ступені окиснення нітрогену в таких сполуках:
N2O3 ,NCI3 , N2H4 , NaNO3 , Ba(NO3)2.
Оксиди Фосфору
|
Фосфор(V) оксид |
Фосфор(ІІІ) оксид. |
|
Емпірична формула P2O5 Це – безбарвна аморфна склоподібна або кристалічна речовина, має молекулярні кристалічні гратки, в узлах яких перебувають молекули P4H10 |
Емпірична формула: P2O3 Це – пластівці або кристали з неприємним запахом, в узлах кристалічних граток містяться молекули P4O6 Кислотний оксид, дуже отруйний, розчиняється у воді |
|
Добувають фосфор(V) оксид спалюванням фосфору:
Термічний продукт має вигляд білої снігоподібної маси, що складається з суміші різних форм фосфор(V) оксиду. енергійно сполучається з водою і водяною парою, утворюючи фосфатні кислоти:
під час нагрівання до метафосфатної кислоти приєднується вода й утворюється ортофосфатна кислота:
як кислотний оксидвзаємодіє з лугами та основними оксидами, утворюючи різні фосфати:
як сильний дегідратуючий агент забирає воду від кислот, утворюючи їх кислотні оксиди, які не можна одержати розкладом цих кислот:
витісняє леткі кислотні оксиди з солей:
|
Р+О2=Р2О3(при недостатній кількості кисню) |
Оксиди Карбону
Карбон з Оксигеном утворює два оксиди: карбон(IV) оксид і карбон(ІІ) оксид.
|
Карбон(ІV) оксид (карбон діоксид, вуглекислий газ).
|
Карбон(ІІ) оксид СО(карбон монооксид, чадний газ) |
|
Фізичні властивості. безбарвний газ, без запаху, важчий за повітря у 1,5 рази, доволі добре розчиняється у воді, особливо під тиском, легко зріджується навіть за кімнатної температури і невеликого тиску (5 МПа). Зріджений карбон(ІV) оксид зберігають у стальних балонах. Якщо його швидко вилити з балона, вуглекислий газ випаровується, внаслідок чого частина газу перетворюється на снігоподібну масу – сухий лід. |
Фізичні властивості. безбарвний газ, без запаху, погано розчиняється у воді, трохи легший за повітря, отруйний. Утворює стійку сполуку з гемоглобіном крові, внаслідок чого кров втрачає здатність переносити кисень в організмі, настає кисневе голодування |
|
Хімічні властивості. Карбон(ІV) оксид – солетворний кислотний оксид. Він взаємодіє з водою, утворюючи нестійку карбонатну кислоту:
взаємодіє з основами і основними оксидами, як у водних розчинах, так і з твердими, утворюючи солі – карбонати:
Якісна реакція на вуглекислий газ – помутніння вапняної води внаслідок утворення нерозчинного кальцій карбонату |
Хімічні властивості. Карбон(ІІ) оксид – несолетворний оксид. За стандартних умов не взаємодіє з водою, кислотами, лугами. Йому притаманні такі властивості: здатність горіти васильково синім полум’ям, виділяючи велику кількість теплоти:
здатність відновлювати метали з оксидів:
взаємодіє з хлором з утворенням фосгену – отруйної речовини, що належить до хімічної зброї:
взаємодіє з твердим натрій гідроксидом з утворенням солі – натрій метаноат (форміат)
|
|
Добування. У лабораторії вуглекислий газ добувають дією хлоридної кислоти на мармур:
У промисловості – прожарюванням вапняку:
Використання. Вуглекислий газ застосовують для: виробництва соди; гасіння пожеж (содові вогнегасники); газування напоїв; виготовлення сухого льоду для зберігання продуктів, які швидко псуються.
|
Добування. У лабораторії карбон(ІІ) оксид добувають з метанової (форміатної, мурашиної) кислоти під дією концентрованої сульфатної кислоти, яка відбирає воду:
У промисловості його добувають різними способами: внаслідок взаємодії карбон(IV) оксиду з розжареним вугіллям за температури понад 450OC в умовах нестачі повітря: CO2 + C = 2CO# дією водяної пари на розпечене вугілля:
Використання. Карбон(ІІ) оксид застосовують: для відновлення металів з їх оксидів; в органічному синтезі (для добування спиртів, вуглеводів, альдегідів, карбонових кислот); як висококалорійне паливо.
|