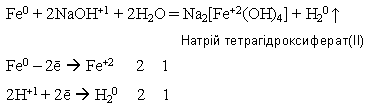- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Алюміній гідроксид
Алюміній гідроксид Al(OH)3 - біла тверда речовина нерозчинна у воді, виявляє амфотерні властивості.
1)Свіжоосаджений алюміній гідроксид взаємодіє і з кислотами, і з лугами (сухий не взаємодіє):
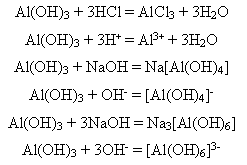
Залежно від молярного співвідношення речовин, що реагують, утворюються або тетра-, або гексагідроксиалюмінат.
2)Під час сплавляння утворюються або мета-, або ортоалюмінат:
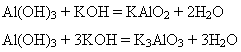
У лабораторних умовах алюміній гідроксид добувають дією розчинів лугів на розчини солей Алюмінію:
![]()
Солі Алюмінію
Солі Алюмінію та алюмінати у водних розчинах дуже гідролізують і перетворюються на основні:

або повністю гідролізують:
![]()
Тому у водних розчинах не утворюються ні карбонати, ні сульфіди, ні сульфіти Алюмінію:
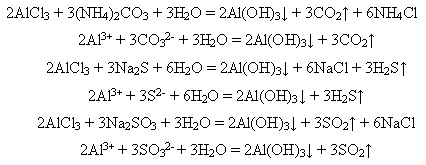

*Здійснити претворення:
1)Алюміній оксид → алюміній сульфат → алюміній нітрат → алюміній гідроксид→гексаалюмінат натрію
2)Алюміній гідроксид→алюміній оксид→алюміній хлорид→алюміній гідроксид→тетраалюмінат калію
3)Алюміній→алюміній оксид→алюмінат натрію→алюміній сульфат→алюміній гідроксид
*2Al + 6HCl =
4Al + 3O2 =
Al2O3 + 6HCl =
AlCl3 + 3NaOH =
2Al(OH)3 =
Ферум
*охарактеризуйте ферум за місцеросташуванням в ПС,напишіть електронну конфігурацію його атома
Найхарактерніші ступені окиснення +2 і +3 (відомі сполуки, де Ферум виявляє ступені окиснення, що дорінюють 0, +4, +6).
За поширенням у природі Ферум посідає четверте місце після Оксигену, Силіцію, Алюмінію. Трапляється у вигляді різних сполук: оксидів, сульфідів, силікатів та ін. У вільному стані – тільки в метеоритах.
Основні мінерали, що містять Ферум:

Фізіологічна дія. У рослин елемент Ферум входить до складу хлорофілу. В разі неcтачі Феруму рослини втрачають здатність асимілювати вуглекислий газ (карбон(IV) оксид). У тваринних організмах Ферум входить до складу гемоглобіну крові, який переносить кисень від органів дихання до різних тканин, а вуглекислий газ – від тканин до органів дихання. Ферум є складовою багатьох окисно-відновних ферментів, що забезпечують тканинне дихання. Сполуки Феруму накопичуються у печінці, кістковому мозку і селезінці. Ферум – необхідний елемент для кровотворення. В організмі людини міститься близько 3 г феруму.
Залізо
Проста речовина, що складається з елемента Феруму, називається залізо.
Фізичні властивості. Чисте залізо – сріблясто-білий блискучий метал, пластичний, відносно м’який, легко кується, прокатується, зварюється. Густина заліза = 7,87 г/см3 температура плавлення tпл=1535oС
Має здатність намагнічуватися.
*який тип зв’язку у заліза
Хімічні властивості.
Залізо належить до металів середньої хімічної активності.Можливі ступені окиснення +2 і +3.
1)взаємодіє з киснем:
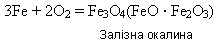
2)під час нагрівання взаємодіє з іншими неметалами – хлором, сіркою, вуглецем, азотом:
*Напишіть рівняння реакції взаємодії заліза з сіркою,фосфором,азотом,вуглецем
3)у розжареному стані (понад 700ОС) взаємодіє з водою (водяною парою):
![]()
4)корозія
На вологому повітрі та у воді, яка містить кисень, залізо зазнає корозії, воно іржавіє, вкриваючись жовто-бурою плівкою, яка переважно складається із ферум(ІІІ) гідроксиду, але плівка не захищає метал від подальшої корозії:
*Напишіть рівняння реакції ржавіння заліза,складіть схему електронного балансу,визначте окисник і відновник.
5)взаємодіє з хлоридною і розбавленою сульфатною кислотами:
*Напишіть рівняння реакції
-Концентрована (безводна) сульфатна кислота пасивує залізо, що дає змогу зберігати і перевозити її у залізних цистернах.
-Концентрована нітратна кислота також пасивує залізо.
6)Залізо відновлює менш активні метали з розчинів їхніх солей:
Fe + CuSO4 = FeSO4 + Cu
7)у подрібненому вигляді залізо може взаємодіяти з концентрованим гарячим розчином лугу з утворенням комплексних гідроксисолей: