
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Сульфати
Більшість солей сульфатної кислоти легко розчиняються у воді. Малорозчинними є плюмбум сульфат і кальцій сульфат, практично нерозчинними у воді та кислотах є барій сульфат і стронцій сульфат.
Якісна реакція на розчинні сульфати – взаємодія з розчинними солями Барію - BaCl2, Ba(NO3)2
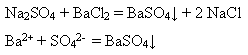
Багато солей сульфатної кислоти кристалізуються із розчинів у вигляді кристалогідратів, які називаються купоросами.
В основному це солі Купруму, Феруму, Ніколу, Кобальту і Цинку.:

Гіпс CaSO4 · 2H2O до купоросів не належить, оскільки Кальцій не є важким металом.
Гіпс CaSO4 · 2H2O так само, як і безводний кальцій сульфат CaSO4 використовують у будівництві, в медицині тощо.
Натрій сульфат Na2SO4 – у виробництві скла, а його кристалогідрат Na2SO4 · 10H2O – глауберову сіль використовують як проносний засіб у медицині.
Калій сульфат К2SO4 та амоній сульфат (NН4)2SO4 служать добривами.
Барій сульфат BaSO4 застосовують у виробництві паперу, гуми та білої мінеральної фарби, а також у медицині для рентгеноскопії шлунку („Барієва каша”).
*До розчину масою 200 г з масовою часткою сульфатної кислоти 9,8% долили розчин натрій гідроксиду, що містив 16 г лугу. Обчисліть масу солі, що утворилась. (28,4 г)
*Мідна руда складається з борніту Cu3FeS3 та пустої породи. Масова частка борніту в руді 10%. З однієї тонни руди виплавляють 50,5 кг міді. Визначте масову частку виходу міді від теоретично можливого. (90,5%)
Нітратна та ортофосфатна кислота
|
Нітратна кислота
|
Ортофосфатна кислота |
|
Молекулярна формула HNO3 молекул вона існує тільки в безводному стані або в парах.
Структурна формула:
Валентність Нітрогену в нітратній кислоті дорівнює IV, а ступінь окиснення +5.
|
У молекулі фосфатної кислоти атоми гідрогену сполучені з атомами оксигену:
У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів Ступінь окиснення фосфору у кислоті +5 |
|
Фізичні властивості. Нітратна, або азотна кислота НNО3 – одна з найважливіших кислот.Безводна нітратна кислота –за звичайних умов є безбарвною рідиною, важчою за воду (p=1,513 г/см3). Вона летка і нестійка. Температура кипіння кислоти за нормального тиску становить 830С. Сполука змішується з водою в будь-яких співвідношеннях, утворюючи розчин. Нітратна кислота є токсичною. Її концентрований розчин спричинює пожовтіння шкіри й опіки. ГДК парів НNО3 в повітрі становить 2 мг/м3.
|
Фізичні властивості. Фосфатна кислота — біла тверда речовина, з т. пл. 42,50С З водою змішується в будь-яких співвідношеннях. На відміну від нітратної кислоти не є окисником і не розкладається при нагріванні, що пояснюється найбільшою стійкістю ступеня окиснення +5 з усіх можливих для фосфору.
|
|
Хімічні властивості. Розведена нітратна кислота має всі властивості кислот. Вона реагує з основами, солями, амфотерними гідроксидами, основними і амфотерними оксидами. Вона належить до сильних кислот. У водних розчинах дисоціює: під дією теплоти і світла частково розкладається Нітратна кислота належить до сильних одноосновних кислот. У водному розчині вона повністю дисоціює на йони: 1)дисоціація
2)взаємодіє з основними оксидами та основами:
3)Взаємодіє з солями, з обмеженою кількістю солей, оскільки нітратна кислота хоч і сильна, але вона летка:
4)Розкладається під час нагрівання і під впливом світла:
5)Взаємодіє з металами. Як сильний окисник нітратна кислота окиснює майже всі метали (за винятком золота, платини та ін.). При цьому водень не виділяється, бо відновлюється Нітроген, а не Гідроген. Лише магній може витіснити водень із нітратної кислоти, та й то на початку реакції, а далі він окиснюється з утворенням води. Нітроген відновлюється тим повніше, чим активніший метал і чим більше розбавлена кислота. Продукти відновлення можуть бути різні: NO2 , NO, N2O, N2 або NH3 , який з нітратною кислотою утворює сіль амоній нітрат. Тому зберігають її в прохолодному і темному місці. Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук: +5 +4 +3 +2 +1 0 -3 -3 HNО3→NО2 →HNО2→ NО →N2О→ N2 → NH3 (NH4NО3). Утворюється також сіль нітратної кислоти.
Згідно зі схемою, концентрована нітратна кислота з важкими металами має відновлюватися до NO2;крім того, будуть утворюватися Н2О та сіль AgN03. Запишемо схему реакції: Ag + 2HNO3(конц.) → AgN03+ NO2+ Н2О. Розведена нітратна кислота при взаємодії зі сріблом (важким металом) відновлюється до NO і утворюються вода і сіль AgN03: 3Ag+ 4HNO3(розв.) → 3AgN03+ NO + 2Н2О; Ще приклад: досить активний метал цинк залежно від концентрації нітратної кислоти може відновлювати її до оксиду нітрогену(І) N2O,вільного азоту N2 і навіть до аміаку NH3, який з надлишком нітратної кислоти дає нітрат амонію NH4NO3. 4Zn + 10HNO3(дуже розв.)= 4Zn (NО3)2 + NH4NO3+ 3Н2О; Слід мати на увазі, що концентрована нітратна кислота за звичайної температури не взаємодіє з алюмінієм, хромом та залізом. Нітратна кислота не реагує з Pt, Rh, Іг, Та, Au. Платина і золото розчиняються у "царській водці" — суміші 3 об'ємів концентрованої хлоридної кислоти і 1 об'єму концентрованої нітратної кислоти. Нітратна кислота взаємодіє з багатьма неметалами, окиснюючи їх до відповідних кислот. Наприклад: S + 2HNО3= H2SO4+ 2NO; 3Р + 5HNО3+ 2Н2О = 3Н3РО4 + 5NO; В + 3HNО3= НзВОз + 3NО2; С + 4HNО3= СО2 + 2Н2О + 4NО2. Взаємодія з солями. СаСО3 +2HNО3= Са (NО3)2 + СО2 ↑+ Н2О Вона також взаємодіє з органічними сполуками. Нітруванням останніх добувають вибухові речовини, органічні барвники, ліки. Взаємодіє з органічними речовинами:
а) реакції нітрування:
б) реакція етерифікації:
в) ксантопротеїнова реакція на білки. Нітратна кислота роз’їдає тканини, спричинює жовті плями на шкірі і виразки |
Хімічні властивості. Взаємодія з металами. Фосфатна кислота, на відміну від нітратної, окисні властивості виявляє набагато слабше, тому реагує тільки з активними металами, утворюючи сіль і водень: 3Mg + 2H3PO4 = Mg2(PO4)2 ↓+ 3H2↑ Фосфат магнію – нерозчинна сіль, викликає пасивацію металу, і реакція припиняється. А в надлишку кислоти реакція відбувається, але з утворенням кислої солі: Mg + 2H3PO4 = Mg(Н2PO4)2 ↓+ 3H2↑ Взаємодія з основами. Кислота реагує зі сполуками основної та амфотерної природи (оксидами, гідроксидами) з утворенням солей – ортофосфатів. Під час таких реакцій можуть утворюватися не тільки середні солі 3NaOH+H3PO4=Na3PO4+3H2O а й кислі – гідроген фосфати, дигідрогенфосфати: 2NaOH+H3PO4(надл)=Na2НPO4+2H2O NaOH+H3PO4(надл)=NaН2PO4+H2O Взаємодія з солями. Оскільки H3PO4 - кислота середньої сили й нелетка, то з нею реагують солі слабких, летких, нестійких кислот – карбонатної, сульфідної, оцтової та ін.: Na2СО3+ 2H3PO4(надл) =2NaН2PO4+СО2+Н2О
|
|
Добування нітратної кислоти. У лабораторних умовах нітратну (азотну) кислоту добувають з її солей дією концентрованої сульфатної кислоти: KNO3+ H2SO4(к)= HNO3+ KHSO4. Реакція відбувається при слабкому нагріванні (сильне нагрівання розкладає HNO3). Суміш речовин нагрівають в установці для перегонки. HNO3 виділяється у вигляді пари, яка при охолодженні конденсується. У промисловості нітратну кислоту добувають каталітичним окисненням аміаку, який, у свою чергу, утворюється при сполученні водню і азоту повітря. Відкриття промислового способу окиснення аміаку до нітратної кислоти належить інженеру-хіміку І. І. Андрєєву — засновнику азотної промисловості в Росії. Він запропонував застосовувати при окисненні аміаку киснем повітря каталізатор — платинову сітку — і реалізував цей спосіб спочатку на дослідній установці в Макіївці (1916), а потім на заводі в Донецьку (колишній Юзовці) (1917). Увесь процес добування нітратної кислоти можна розділити на три етапи:
4NH3+ 5О2 = 4NО + 6Н2О;
2NО + О2 = 2NО2;
4NО2+ 2Н2О + О2 = 4HNО3. (3NО2 + Н2О= 2HNО3+ NО) Вихідні продукти — аміак і повітря — старанно очищають від шкідливих домішок, що отруюють каталізатор (сірководень, пил, масла тощо). За цим способом утворюється розведена (40—60 %-ва) кислота. Концентровану нітратну кислоту (96—98 %-ву) добувають перегонкою розведеної кислоти у суміші з концентрованою сульфатною кислотою. При цьому випаровується тільки нітратна кислота. Розведену нітратну кислоту зберігають і перевозять у тарі з хромистої сталі, концентровану — в алюмінієвій тарі. Невелику кількість її зберігають у скляних бутлях.
|
Добування ортофосфатної кислоти. У промисловості фосфатну кислоту добувають двома способами: екстракційним і термічним. За першим способом подрібнений фосфат кальцію обробляють сульфатною кислотою: Са3(РО4)2 + 3H2SO4= 2Н3РО4 + 3CaSО4↓. CaSО4випадає у вигляді осаду, а кислота залишається в розчині. Разом з кислотою в розчин переходить багато домішок — сульфати феруму, алюмінію та ін. Така кислота використовується при виробництві добрив. Другим способом спочатку добувають фосфор (відновленням природного фосфору в електропечі). Далі його окиснюють до оксиду Р2О5, а останній сполучають з водою і дістають чисту кислоту (концентрація до 80 %).
|
|
Застосування. Азотна кислота — один з найважливіших продуктів основної хімічної промисловості. Велика кількість її витрачається на виробництво азотних добрив, вибухових речовин, лікарських речовин, барвників, пластичних мас, штучних волокон та інших матеріалів. Димляча нітратна кислота застосовується у ракетній техніці як окисник ракетного пали
|
Застосування. Ортофосфатна кислота не отруйна і найбільш широко застосовується у виробництві мінеральних добрив, крім того, вона використовується у харчовій промисловості для виготовлення сиропів.
|
*напишіть рівняння реакції концентрованої та розбавленої нітратної кислоти з калієм,алюмінієм,залізом,міддю,кальцієм,барієм,сіркою,фосфором.
*Яку масу нітратної кислоти можна добути з 20,2 г калій нітрату при дії на нього надлишком сульфатної кислоти, якщо масова частка практичного виходу нітратної кислоти складає 0,98. (12,348 г)
*Яку масу розчину фосфатної кислоти з масовою часткою розчиненої речовини 65% можна одержати з кальцій фосфату масою 10 т, якщо масова частка практичного виходу складає 92%? (8,95 т)
*Яка маса фосфориту необхідна для виробництва 5 т фосфору, якщо масова частка виходу продукту реакції складає 96% від теоретично можливого? (26 т)
У водному розчині фосфатна кислота дисоціює ступінчасто. Як триосновна кислота, вона утворює солі — фосфати — трьох видів:
1) фосфати — заміщено всі атоми гідрогену у фосфатній кислоті, наприклад К3РО4 — фосфат калію, (NH4)3P04-т фосфат амонію;
2) гідрогенфосфати — заміщено два атоми гідрогену кислоти, наприклад К2НРО4 — гідрофосфат калію, (NH4)2HP04— гідрофосфат амонію;
3) дигідрогенфосфати — заміщений один атом гідрогену кислоти, наприклад КН2РО4 — дигідрофосфат калію, NH4H2PO4- дигідрофосфат амонію.
Усі фосфати лужних металів і амонію розчиняються у воді. З кальцієвих солей фосфатної кислоти розчиняється у воді лише дигідрофосфат кальцію. Гідрофосфат кальцію і фосфат кальцію розчинні в органічних кислотах (органічні кислоти є в підзолистих і торфових ґрунтах).
Класифікація добрив. Мінеральні добрива поділяють на прості (однобічні) і комплексні (складні та змішані).
Прості добрива містять один поживний елемент. Наприклад, натрієва селітра містить нітроген, а хлорид калію — калій і т. д.
Складні добрива в однорідних частинках містять два і більше поживних елементів. Наприклад, калійна селітра містить калій і нітроген, нітрофоска — нітроген, фосфор, калій і т. д.
Змішані добрива — це механічні суміші різних видів добрив — простих, складних або тих і інших. Вони часто називаються тукосумішами.
Мінеральні добрива часто називають туками, а промисловість, що їх виробляє,— туковою. Нині вона випускає понад 40 видів мінеральних добрив.
Найбільше значення мають азотні, фосфорні та калійні добрива. Найголовніші з них представлено в таблиці 1.
Азотні добрива містять зв'язаний азот. Це селітри (нітрати натрію, калію, амонію і кальцію), солі амонію, рідкий аміак, аміачна вода, сечовина CO(NH2)2(застосовується і як кормовий засіб для худоби, містить найбільше азоту — 47 %) та ін. Із цих добрив тепер найширше застосовується аміачна селітра, тобто нітрат амонію. Щоб він не злежувався, його випускають у гранульованому (зернистому) вигляді.
Фосфорні добрива — це кальцієві та амонійні солі фосфатної кислоти. Вони становлять половину всіх мінеральних добрив, що виробляються. Найпоширенішими фосфорними добривами є такі.
Фосфоритне борошно, яке добувають при тонкому розмелюванні фосфоритів. Оскільки воно містить малорозчинну сіль Са3(Р04)2, то засвоюватися рослинами може тільки на кислих ґрунтах — підзолистих і торф'яних. Засвоєнню сприяє м'якість помелу, а також внесення його в ґрунт разом з кислими добривами, наприклад з (NH4)2S04або гноєм.
Простий суперфосфат, який добувають обробкою апатитів і фосфоритів сульфатною кислотою. Мета обробки — добути розчинну сіль, що добре засвоюється рослинами у будь-якому ґрунті:
Са3(Р04)2 + 2H2SO4= Са(Н2Р04)2 + 2CaS04.
Суміш добутих солей Са(Н2Р04)2, і CaS04звичайно і називається простим суперфосфатом. Його виробляють у дуже великих кількостях як в гранульованому вигляді, так і у вигляді порошку.
Гранульоване добриво має ряд переваг порівняно з порошковим: його легше зберігати (не злежується); зручніше вносити у ґрунт за допомогою тукових сівалок, а головне — на більшості ґрунтів воно дає вищий приріст урожаю.
Подвійний суперфосфат — концентроване фосфорне добриво складу Са(Н2Р04)2. Порівняно з простим суперфосфатом не містить баласту — CaS04. Добування подвійного суперфосфату здійснюють у дві стадії. Спочатку добувають фосфатну кислоту. Потім водним розчином фосфатної кислоти обробляють апатит або фосфорит. Кількість вихідних продуктів беруть відповідно до рівняння:
Са3(РО4)2 + 4Н3РО4 = 3Са(Н2РО4)2
Преципітат — концентроване фосфорне добриво складу СаНРО4·2Н2О. Малорозчинний у воді, але добре розчиняється в органічних кислотах. Утворюється при нейтралізації фосфатної кислоти розчином гідроксиду кальцію: Н3РО4 + Са(ОН)2 = СаНРО4 ∙ 2Н2О.
Кісткове борошно, яке добувають переробкою кісток домашніх тварин, містить Са3(РО4)2.
Амофос — добриво, що містить фосфор і нітроген. Утворюється при нейтралізації фосфатної кислоти аміаком. Звичайно містить солі NH4H2PO4та (NH4)2НРО4.
Отже, фосфорними добривами є кальцієві та амонійні солі фосфатної кислоти.







