
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Сульфур
|
Ступінь окиснення |
-2 |
0 |
+2 |
+4 |
+6 |
|
Приклади |
|
|
|
|
|
Алотропні видозміни Сульфуру. Природною алотропною видозміною Сульфуру є ромбічна сірка. Це лимонно-жовта, крихка, кристалічна речовина без запаху,
нерозчинна у воді. Назва пов’язана з тим, що її кристалимають форму октаедра зі зрізаними кутами .
Молекула такої сірки складається з 8 атомів Сульфуру(у рівняннях реакцій послуговуються записом одного атома S).При температурі +119,5 °С ромбічна сірка плавитьс й перетворюється на моноклінну сірку — майже білі кристалічні пластинки . Ця алотропна видозміна Сульфуру нестійка і вже при температурі +95,6 °Сзнову перетворюється на ромбічну сірку.Якщо доведену до кипіння сірку (температуракипіння +444,6 °С) вилити в холодну воду, то під впливом різкого перепаду температур вона перетвориться напластичну сірку .
Пластична сірка має жовто-коричневий колір, ріжеться ножем, гумоподібна й еластична (витягується в нитки). На повітрі вона за кількаднів знову стає ромбічною сіркою.
До досягнень сучасної хімії належить створеннякластерних частинок. Кластер у хімії — це складне об’єднання атомів чи молекул, яке є самостійною частинкою йнаділене певними властивостями. Кластерні частинки з60–70 атомів Карбону дістали назву фулерени і вуглецевінанотрубки . З їх відкриттям набули стрімкогорозвитку нанотехнології
У природі сірка трапляється у вільному стані (самородна сірка) і у вигляді різних мінералів:
|
|
|
Сірка входить до складу білків, тому без сірки неможливий розвиток рослин і тварин.
Фізичні властивості.
Сірка – тверда речовина жовтого кольору, не має металічного блиску, не проводить електричний струм, нерозчинна у воді, але розчиняється у сірковуглеці СS2 та інших органічних розчинниках. За стандартних умов стійкішою є ромбічна модифікація.
Застосування сірки.
-виробництво сульфатної кислоти та сульфатів;
-добування барвників, гуми, чорного пороху, сірників, ліків;
-у сільському господарстві для боротьби зі шкідниками
Добування сірки:
2H2S+O2=2S+2H2O
2SO2+4H2S=6S+4H2O
FeS2=FeS+S
Хімічні властивості сірки:
За високих температур сірка взаємодіє з усіма речовинами, за винятком азоту, золота і платини, виявляючи, залежно від умов властивості окисника чи відновника:
взаємодіє з металами з утворенням сульфідів:

взаємодіє з неметалами (за винятком азоту, йоду та інертних газів):

взаємодіє з окисниками і відновниками:
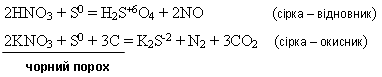
Карбон
|
Можливі ступені окиснення |
- 4 |
0 |
+ 2 |
+ 4 |
|
Приклади |
|
|
|
|
Відомо кілька алотропних модифікацій Карбону – алмаз, графіт, карбін, фулерен. Це тверді речовини з атомними кристалічними гратками, які різняться будовою кристалів і фізичними властивостями.
