
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Вуглець
Хімічні властивості
Вуглець виявляє невисоку хімічну активність: більшість реакцій за його участю відбувається лише за високої температури.
Найголовніша хімічна властивість вуглецю – його відновна здатність. Вуглець – чудовий відновник:
взаємодіє з киснем. Вуглець легко горить на повітрі. При цьому виділяється багато теплоти, що свідчить про велику міцність зв’язків у молекулі карбон(IV) оксиду, що утворюється:
![]()
Продукт реакції залежить від температури. За порівняно невисоких температур горіння утворюється карбон діоксид (карбон(IV) оксид), а за високих (понад 1000OC) – поряд із карбон діоксидом утворюється карбон монооксид (карбон(ІІ) оксид):
![]()
взаємодіє з водою. Якщо на розжарений вуглець подавати водяну пару, то внаслідок реакції утвориться водяний газ – суміш карбон(ІІ) оксиду і водню:
![]()
Водяний газ використовують як сировину для синтезу хімічних продуктів.
відношення до лугів та кислот. Вуглець стійкий до дії лугів і кислот. Лише концентровані сульфатна і нітратна кислоти за температури 100OC окиснюють його:

взаємодіє з металами з утворенням карбідів:

У реакціях вуглець виступає як окисник, що для нього не характерно.
взаємодіє з воднем за високої температури і наявності каталізатора:

Прозорі алмази красивого синього, зеленого, червонуватого кольору надто рідкісні й оцінюються дуже високо. Чим більше граней має кристал, тим краще він «грає». Маса діамантів вимірюється каратами (1 карат = 0,2 г).
Найбільший з будь-коли знайдених на Землі алмазів — це алмаз «Куллінан». Його знайшли у 1905 р. Назву він здобув від імені одного із володарів. До огранювання його розмір був з жіночий кулак і маса 3106 каратів, тобто 621 г. Під час обробки алмаз розкололи за напрямом тріщин, що були у ньому, і вирізали 105 діамантів. Найбільший серед них назвали «Зоряна Африка». Він має форму краплі і масу 530 каратів.
Цікаво, що серед індійських алмазів є славнозвісний «Шах» масою 89 каратів, яким перський уряд, щоб «уласкавити білого царя», розплатився за кров відомого російського дипломата і видатного письменника О. С. Грибоєдова, полеглого від рук розлюченого натовпу перських фанатиків у 1829 р. у Тегерані — столиці Персії.
Розроблено штучне добування алмазів (1954 p., США) з графіту в умовах високих тисків і температур. Як правило, утворюються дрібні кристали. Їх використовують для виготовлення різальних інструментів і як опору для підшипників та інших рухливих частин у точних вимірювальних інструментах. Нині виробляються й синтетичні алмази ювелірної якості. Промисловий синтез алмазів — велике досягнення науки і техніки.
*Який ступінь окиснення виявляє атом Карбону в молекулі метану СН4? Як ви гадаєте, окисником чи відновником у даному разі є вуглець. Чому для нього взаємодія з воднем нехарактерна?
*Здійснити перетворення
С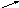 aCI2
aCI2
C → CO2→CO → CO2 → CaCO3
C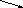 O2
→ H2CO3
O2
→ H2CO3
Фосфор
|
Можливі ступені окиснення |
-3 |
0 |
+3 |
+5 |
|
Приклади |
|
|
|
|
|
|
|
|
Алотропні видозміни Фосфору. Серед алотропнихвидозмін Фосфору найбільш поширені: білий фосфор(молекулярна будова кристалічної ґратки), червоний і чорний фосфор (атомна будова кристалічної ґратки). Усівони — тверді речовини з кольором, зазначеним у назві.Змінюючи температуру, одну алотропну видозміну Фосфору можна за кілька годин перетворити на іншу.
|
Білий фосфор |
Червоний фосфор |
Чорний фосфор |
|
безбарвна, з часниковим запахом,воскоподібна речовина, що світиться в темряві, дуже отруйна, самозаймається на повітрі при температурі+50 °С. Унаслідок високої хімічної активності його зберігають під водою і по можливості в темряві |
порівняно з білим стійкіший до нагрівання, без запаху, менш реакційно здатний і неотруйний. Його використовують у виробництві сірників (входить до складу намазки сірникової коробки). Пришвидкому проведенні головкою сірника по намазці фосфор окиснюється наявною в головці речовиною калійхлоратом KClO3. Від цього інша речовина головки — сірка — загорається й підпалює дерев’яну частину сірника |
має подібну з графі том будову і прово дить елект ричний струм |
У природі Фосфор трапляється тільки в сполуках.
Найважливіші мінерали, до складу яких увіходить кальцій фосфат – це фосфорити й апатити.
Ca3(PO4)2
Фосфор – життєво важливий елемент для організму людини, тварин і рослин. В організмі людини він виявлений у складі всіх тканин, особливо нервової і кісткової, входить до складу деяких ферментів, міститься в зубах.
Хімічні властивості.
Фосфор хімічно активніший ніж азот. Його активність залежить від алотропної форми. Найактивніший білий фосфор. Хімічна формула фосфору, умовна для всіх його алотропних форм, - Р.
Взаємодіє з металами:

Фосфіди розкладаються водою – реакція гідролізу – з утворенням фосфінуРН3(безбарвний газ, дуже токсичний, легко окиснюється на повітрі, має запах гнилої риби):

Взаємодіє з неметалами. З воднем фосфор практично не взаємодіє
*напишіть рівняння реакції взаємодії фосфору з неметалами
Взаємодіє з сильними окисниками:

Добування.
Фосфор добувають із кальцій фосфату (складова фосфориту і апатиту) за допомогою піску і коксу. Суміш прожарюють в електропечах:

Використання.
Білий фосфор широкого використання не має. Його застосовують для добування інших алотропних форм, фосфатних кислот, як бойову запалювальну речовину і для утворення димових завіс. Червоний фосфор:
для виробництва сірників;
у металургії як розкисник під час добування сплавів;
для одержання феромагнітних плівок в елементах пам’яті обчислювальних машин;
для добування напівпровідникових фосфідів;
для добування фосфорорганічних препаратів – засобів знищення комах – шкідників сільськогосподарських рослин.
У 1831 р. французький винахідник сірників Шарль Соріа почав застосовувати білий фосфор для виготовлення сірникових головок. Такі сірники легко займалися піц час тертя об будь-яку поверхню, але були отруйними, шкідливими для здоров'я і вогненебезпечними. Невдовзі від них відмовились.
Сучасні безпечні сірники винайдено у 1855 р. в Швеції. Білий фосфор замінено червоним. Він входить не до складу головки сірника, а до складу намазки, що наноситься на коробку (разом із сульфідом стибію (III) Sb2S3, залізним суриком Fe203, домішкою кварцу SiO2 і клею). Головки сірників складаються, головним чином, з бертолетової солі КСl03, молотого скла, сірки та клею. Під час тертя головки по намазці сірникової коробки червоний фосфор займається, підпалює головку, а від неї загоряється дерево.
Крім виробництва cірників, фосфор застосовують у металургії. Використовують його і для виготовлення напівпровідників, фосфорорганічних препаратів — засобів знищення комах — шкідників сільськогосподарських рослин.
*Обчисліть, чи вистачить 100 л кисню (н. у.) для спалювання 100 г фосфору. *3 5 т фосфату кальцію, якщо вихід продукту становить 90% від теоретичного, можна добути фосфор масою
