
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Отримання алкенів
Промислові методи
1. Крекінг алканів нафти

Лабораторні методи
1. Дегідратація спиртів

2. Відщеплення галогенів (Cl, Br)
![]()
3. Гідрування алкінів
![]()
Отримання алкінів
Промислові методи отримання ацетилену
1. гідроліз ацетилениду (карбіду) кальцію

2. піроліз метану
![]()
Лабораторні методи
1. отримання через галогенпохідні

2. отримання через галогенпохідні і ацетиленид натрію
R-Cl + NaC≡CH →R-C≡CH + NaCl
*Здійсніть перетворення:С2Н5І → С4Н10 →С4Н8 →С4Н9Сl
*СН4 → С2Н2 → С2Н4 → (- СН2 – СН2 -)
↓
С2Н5Br → C2H5OH
*метан—вуглець—метан—хлорометан—вуглекислий газ
Отримання і хімічні властивості ароматичних вуглеводнів
Отримання
Промислові методи отримання бензолу і його гомологів
1. перегонка кам'яновугільної смоли
2. каталітичний риформінг нафти
3. реакція Реппе

Лабораторні методи
1. дегідрогенізація циклогексану

2. дегідроциклізація гептану
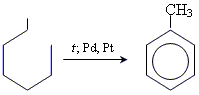
Хімічні властивості бензолу
1. реакції приєднання

2. реакції заміщення
• реакція нітрування

• реакція сульфування

• реакція Фриделя-Крафса
•• алкілювання

•• ацилювання

• реакції галогенування (Cl, Br)

Хімічні властивості толуолу
1. реакції заміщення
реакції заміщення протікають значно легше, ніж у випадку бензолу, оскільки метильна група суттєво активує бензольне ядро.
• реакція нітрування


• реакція сульфування
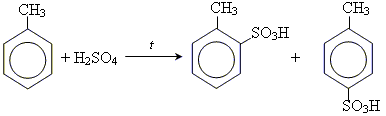
• реакція Фріделя-Крафса

• галогенування за вільнорадикальним механізмом (Cl2 або Br2)

2. реакції окиснення толуолу

*етан—етен—етин—бензен--хлорбензен
*етан—бромоетан—А—етен—Б—бензен
*через розчин,що містить бром,масою 50г пропустили ацетилен об’ємом 5,6л.Яка речовина утворилась і яка її маса?
*на технічний кальцій карбід масою 1т з масовою часткою домішок 30% подіяли водою.Який об’єм етину н.у. виділився,якщо обємна частка виходу продукту становить 80%?
Розв'язування задач на виведення молекулярної формули речовини.
1.Вуглеводень має такий елементарний склад: 85,7% Карбону та 14,3% Гідрогену. Густина його пари за повітрям становить 2,415. Знайдіть молекулярну формулу цього вуглеводню.
|
Дано W(C) = 85,7% W(H) = 14,3% Dпов (СхНу) = 2,415 |
Розв’язання 1.Знайдемо маси елементів, які входять до складу вуглеводню за формулою: m(ел) = w(E)·m(роз) для цього приймемо масу вуглеводню за 100г. Звідси m(С) = w(E)·m(СхНу) = 0,857·100 = 85,7 (г) m(Н) = w(Н)·m(СхНу) = 0,143·100 = 14,3 (г) 2.Обчислюємо кількості елементів Карбону і Гідрогену:
ν(C)
=
ν(H)
= 3.Знайдемо число атомів кожного елемента у найпростішій сполуці ν(C) : ν(H) = х: у
1 : 2 Формула: СН2 4.Обчислюємо молярну масу вуглеводню М(СхНу) = Dпов (СхНу) · Мпов = 2,415·29 =76 (г/моль) 5.Визначаємо у скільки разів молярна маса вуглеводню більша за найпростішу сполуку.
Отже, формула вуглеводню С5Н10. Відповідь: С5Н10. |
|
СхНу –? |
2.При спалюванні 4,2 г вуглеводню утворилось 13,2 г карбон (IV) оксиду. Густина парів сполук за воднем 42. Визначити формулу вуглеводню.
|
Дано m(СхНу ) = 4,2 г m(СО2) = 13,4 г DН2(СхНу) = 42 |
Розв’язання 1.Знайдемо молярну масу вуглеводню: М(СхНу) = DН2 (СхНу) · МН2 = 42·2 = 84 (г/моль) 2.Обчислюємо кількість молей речовини:
ν(СхНу
) = 3.Знаходимо кількість молей Карбону 4.Знайдемо кількість атомів Карбону
ν(C)
= 5.Знаходимо кількість атомів Карбону М(СхНу) = 6Ar(C) + yAr(H) 84 = 72 +y y = 12 формула сполуки С6Н12. Відповідь: С6Н12. |
|
СхНу –? |
3. Згорів вуглеводень масою 8 г, утворився карбон (IV) оксид об’ємом 13,44 л і вода масою 7,2 г. Відносна густина за киснем 1,25. Знайдіть молекулярну формулу, складіть структурну формулу та назвіть її.
|
Дано m(СхНу ) = 8 г m(СО2) = 13,44 г m(Н2О) = 7,2 г DО2(СхНу) = 1,25 |
Розв’язання 1.Знаходимо молярну масу вуглеводню М(СхНу) = DО2 (СхНу) · МО2 = 1,25·32 = 40 (г/моль) 2.Знайдемо кількість речовини вуглекислого газу
ν(CО2)
= 3.Знайдемо масу вуглекислого газу M(CO2) = ν(CO2)·M(CO2) = 0,6·44 = 26,4 (г) 4.За законом збереження маси знайдемо масу Карбону, Гідрогену в 44г СО2 міститься 12г С 26,4г – х г
х
=
в 18г Н2О міститься 2г Н 7,2г – х г
х
=
х
: у =
х
: у = х : у = 0,6 : 0,8 х : у = 3 : 4 Отже, формула С3Н4 СН ≡ С – СН3 Відповідь: С3Н4 |
|
СхНу –? |
4.Згорів вуглеводень масою 5,2 г утворився карбон (IV) оксид масою 17,6 г і вода, масою 3,6 г. відносна густина за воднем 13. Знайдіть молекулярну формулу сполуки та назвіть її.
5.При спалюванні 10 г органічної речовини утворюється 27,5 г вуглекислого газу і 22,5 г води. Відносна густина пари речовини за киснем 0,5. Виведіть молекулярну формулу речовини.
6.Внаслідок спалювання 8,8 г вуглеводню утворюється 26,4 г карбон (IV) оксиду. Маса 1 л речовини за н.у. 1,96 г. яка молекулярна формула вуглеводню.
