
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Розбавлена сульфатна кислота
виявляє всі хімічні властивості, характерні для кислот:
1)змінює колір індикатора
*напишіть як буде змінюватись колір індикаторів в присутності кислот
– лакмус,
-метиловий оранжевий
-фенолфталеїн
2)дисоціація
*скількох основна сульфатна кислота?
*напишіть її дисоціацію поступенево
I
II
Сульфатна кислота здатна утворювати два ряди солей: середні солі – сульфати і кислі солі – гідрогенсульфати;
3)взаємодіє з основами:
|
|

Кислі солі – гідрогенсульфати – утворюються тоді, коли кислота береться у надлишку;
4)взаємодіє з оксидами металів:
*напишіть рівняння реакції
5)взаємодіє із солями.
Як сильна, нелетка і найстійкіша з відомих мінеральних кислот, вона здатна витісняти із солей слабкіші, або леткі, або навіть сильні кислоти, якщо вони менш стійкі:
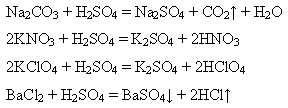
Останнє рівняння відображує якісну реакцію на сульфатну кислоту та її солі.
Реактивом на йони SO42-- служать йони Ва2+, утворюється білий осад барій сульфату BaSO4, нерозчинний у воді і в кислотах.
|
|
6)взаємодіє із солями –сульфатами, перетворюючи їх на кислі солі – гідрогенсульфати:
![]()
7)взаємодіє з металами, що стоять у ряду активності металів лівіше водню:
*напишіть рівняння реакції взаємодії кислоти з натрієм,кальцієм,магнієм,залізом та міддю
Малоактивні метали (мідь, срібло, золото) з розбавленою сульфатною кислотою не реагують.
Концентрована сульфатна кислота
– сильний окисник:
1)взаємодіє з малоактивними металами (крім золота та платини) з виділенням сульфур(IV) оксиду:

Зверніть увагу: відновлюється не Гідроген, а Сульфур!
2)взаємодіє з активними металами з виділенням H2S і SO2 :
![]()
Із залізом, кобальтом, нікелем 100% сульфатна кислота не реагую, реагує тільки 70%:
![]()
3)взаємодіє з неметалами (P, C, S):

4)взаємодіє із спиртами з утворенням етерів:

5)бвуглює целюлозу, сахарозу тощо.
*напишіть рівняння реакції взаємодії концентрованої сульфатної кислоти з натрієм,сріблом,міддю
*вкажіть речовини з якими не будевзаємодіяти концентрована сульфатна кислота:залізо,золото,магній,літій,алюміній.Для решти напишіть ріняння реакції,визначте окисник і відновник.
*Дано речовини: BaO, Zn, SO3, Al2O3, Cu, P2O5. З якими реагуватиме сульфатна кислота? Запишіть рівняння реакцій.
Добування і застосування сульфатної кислоти
Найсучасніший спосіб добування сульфатної кислоти – це контактний.Як сировина використовується пірит, або залізний колчедан. Він складається з таких стадій.
1.Перша стадія процесу – випалювання колчедану і добування сульфур(IV) оксиду:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2‹; DH = -13476 кДж
Процес відбувається у колчеданних печах, з яких виходить випалювальний газ
Він містить, окрім діоксидів, різні домішки. Його очищують, висушують і подають у контактний апарат.
2.Друга стадія – окиснення сульфур діоксиду і добування сульфур триоксиду:
![]()
Окиснення відбувається в контактному апараті за наявності каталізатора і високої температури, незважаючи на те, що реакція екзотермічна. Це пояснюється тим, що каталізатор стає активним лише при температурі 450OC.
Теплоту відводять і використовують для нагрівання випалювального газу, який в очисних спорудах встигає охолонути.
3.Третя стадія виробництва – поглинання сульфур триоксиду й утворення сульфатної кислоти.
В абсорбері сульфур триоксид поглинається концентрованою сульфатною кислотою (w(H2SO4) = 96-98%). Тут він взаємодіє з водою, що є в концентрованій сульфатній кислоті, утворюючи безводну, 100%-ву сульфатну кислоту – моногідрат:
![]()
Чистою водою поглинати сульфур триоксид не можна, бо утворюється стійкий „туман” із дрібних крапель сульфатної кислоти, який майже не конденсується.
Кінцевий продукт виробництва – олеум, тобто розчин сульфур триоксиду в моногідраті. Його розбавляють водою до потрібної концентрації.
*Здійсніть претворення
SO2 → H2SO3 → ZnSO3 → ZnS
↓
SO3↔ H2SO4 → CuSO4 → Cu(OH)2 → CuO → Cu
↓
BaSO4
Використання
Сульфатну кислоту застосовують для:
добування мінеральних добрив (суперфосфату, амоній сульфату);
виробництва купоросів (залізного, мідного);
одержання барвників, пластмас, штучного волокна, лікарських і вибухових речовин, летких кислот;
сушіння різних речовин (як водовідбираючий засіб), очищення нафтопродуктів та поверхонь металів від оксидів.
