
- •Повторення основних питань курсу хімія
- •Валентність атомів деяких елементів у сполуках
- •Класифікація неорганічних сполук Оксиди
- •Класифікація
- •Добування
- •Хімічні властивості
- •Хімічні властивості
- •Кислоти
- •За числом атомів водню, які можуть заміщуватися на метал:
- •Добування
- •Хімічні властивості
- •Класифікація
- •Середні солі Добування
- •Хімічні властивості
- •Окисно-відновні реакції
- •Неметали та їх сполуки
- •Взаємодія неметалів з металами:
- •2. Взаємодія неметалів із неметалами.
- •Добування кисню:
- •Властивості кисню й озону
- •Сульфур
- •Алотропні видозміни Карбону
- •Вуглець
- •Нітроген
- •Сполуки неметалічних елементів ізГідрогеном
- •Хлороводень і хлороводнева кислота
- •Амоніак
- •Солі амонію
- •Виділення амоніаку – характерна ознак для розпізнавання солей амонію.
- •Розв’язування розрахункових задач на надлишок та вихід продукту.
- •1.Розвязування задач на визначення масової частки, об’єму та кількості речовини.
- •Самостійна робота:
- •Розв’язування задач на надлишок
- •Розв’язування задач на вихід продукту реакції
- •Оксиди неметалічних елементів. Оксиди Сульфуру
- •Оксиди Нітрогену
- •Хімічні властивості.
- •Оксиди Фосфору
- •Оксиди Карбону
- •Оксиди силіцію
- •Сульфатна кислота
- •Розбавлена сульфатна кислота
- •Концентрована сульфатна кислота
- •Добування і застосування сульфатної кислоти
- •Сульфати
- •Нітратна та ортофосфатна кислота
- •Мінеральні добрива
- •Карбонатна і силікатна кислота
- •Кристалічні гратки металів
- •Загальні фізичні властивості металів
- •Хімічні властивості металів.
- •Фізичні властивості лужних металів
- •Хімічні властивості лужних металів
- •Добування лужних металів
- •Оксиди лужних металів
- •Застосування оксидів лужних металів.
- •Гідроксиди лужних металів
- •Лужно-земельні метали
- •Кальцій
- •Кальцій оксид
- •Кальцій гідроксид
- •Алюміній
- •Алюміній оксид
- •Алюміній гідроксид
- •Солі Алюмінію
- •Оксиди і гідроксиди Феруму
- •Сполуки Феруму(ііі).
- •Органічна хімія
- •Отримання алкенів
- •Отримання алкінів
- •Отримання і хімічні властивості ароматичних вуглеводнів
- •Розв'язування задач на виведення молекулярної формули речовини.
- •Оксигеновмісні органічні сполуки
- •Альдегіди і карбонові кислоти
- •Естери і жири
- •Отримання і хімічні властивості жирів
- •Вуглеводи
- •Глюкоза
- •Сахароза
- •Крохмаль і целюлоза
- •Характеристики амінів
- •Амінокислоти
- •Реакції амінокислот
- •Загальні правила роботи і техніка безпеки в хімічній лабораторії
Амоніак
• Зазначте електронні формули атомів Нітрогену і Гідрогену, покажіть графічно розміщення електронів по орбіталях і поясніть, якими електронами утворюється ковалентний зв'язок у молекулі аміаку і чому він полярний. Яка валентність і ступінь окиснення Нітрогену в аміаку?
Молекулярна формула NH3
Молекула має форму піраміди з атомом Нітрогену у вершині та кутом 107° між ковалентними полярними зв’язками N – H, внаслідок чого вона полярна. Ступінь окиснення Нітрогену становить -3.
У природі амоніак утворюється під час гниття органічних решток.
Фізичні властивості. Амоніак – безбарвний газ, з різким запахом, набагато легший за повітря, дуже добре розчиняється у воді (за температури 20OC в 1 об’ємі води – 700 об’ємів амоніаку).
Водний розчин амоніаку називають амоніачною водою, або нашатирним спиртом, масова частка амоніаку в ньому дорівнює 25%. Амоніак легко зріджується, за температури -33,4OC переходить у рідкий стан.
Хімічні властивості.
1)горіння
Як відновник амоніак окиснюється киснем і горить у ньому зеленкуватим полум’ям.
4NH3 + 3O2 = 2N2 + 6H2O (горінняамоніаку)
2)неповне окиснення
За наявності каталізатора (Pt, Fe2O3) і нагрівання під час окиснення амоніаку утворюються два оксиди:
![]()
• Складіть для наведених рівнянь електронний баланс, обґрунтуйте розстановку коефіцієнтів і доведіть, що аміак в обох випадках — відновник.
3)взаємодія з водою
Амоніак взаємодіє з водою. Велика розчинність амоніаку у воді пояснюється утворенням водневих зв’язків між молекулами амоніаку і води:

Встановлюється рівновага:
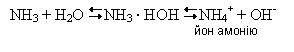
У розчині лише невелика частка молекул амоніаку перетворюється на йони амонію, тому амоніачна вода пахне амоніаком. ЇЇ позначають формулою NH3 · H2O і називають амоній гідроксидом або нашатирним спиртом. Він належить до слабких і нестійких основ:
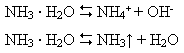
4)взаємодія з кислотами
Амоніак взаємодіє з кислотами, утворюючи солі амонію:
*напишіть реакції взаємодії амоніаку з хлоридною,нітратною,сульфатною,фосфатною кислотами
Амоній-іон NH4+ -це комплексний йон. Він утворюється внаслідок приєднання молекулою амоніаку протона (йона Гідрогену), що відщеплюється від молекули кислоти або води. Виникаєковалентний зв’язокза донорно-акцепторним механізмом: атом Нітрогену амоніаку – донор, а йон Гідрогену – акцептор. Усі чотири зв’язки N – H в йоні амонію рівноцінні, незважаючи на різні механізми їх утворення.
*Що спільного і відмінного між речовинами, назви яких «нашатир» і «нашатирний спирт»?
.Добування.
-У лабораторії амоніак добувають із суміші твердих речовин – нашатирю NH4Cl і гашеного вапна Ca(OH)2:
Добування аніаку в лабораторних умовах.
![]()
-У промисловості амоніак синтезують із простих речовин азоту і водню:

Реакція оборотна, екзотермічна, відбувається між газами із зменшенням об’єму. Звідси оптимальні умови синтезу амоніаку:
застосування тиску (30 МПа) для зміщення рівноваги у бік утворення амоніаку;
використання каталізатору (Fe);
підвищення температури (450- 550OC).
Використання.
Амоніак застосовують:
для виробництва нітратної кислоти, солей амонію, вибухових речовин, соди, барвників;
як добривоі для добування азотних добрив, у тім числі й карбаміду (сечовини):
![]()
як холодоагент у холодильних установках;
у медицині як нашатирний спирт;
у хімічних лабораторіях як слабкий луг;
у побуті під час прання білизни, для виведення плям, чищення килимів і ювелірних виробів.
