
- •Глава I. Физические основы динамики.
- •§1.1. Предмет механики. Кинематика и динамика. Классическая механика. Квантовая механика. Релятивистская механика.
- •§1.2. Силы.
- •§1.3. Элементы кинематики.
- •§1.4. Пространство и время.
- •§1.5. Кинематическое описание движения.
- •§1.6. Вектор перемещения. Скорость. Ускорение.
- •§1.7. Движение точки по окружности.
- •§1.8. Линейная скорость точки.
- •§1.9. Связь между угловыми и линейными параметрами движения.
- •Решение:
- •§1.10. Элементы динамики поступательного движения. Основная задача динамики. Понятие состояния в классической механике. Масса, импульс, сила.
- •§1.11. Современная трактовка законов Ньютона.
- •§1.12. Второй закон Ньютона как уравнение движения импульса.
- •§1.13. Третий закон Ньютона.
- •§1.14. Закон сохранения импульса.
- •§1.15. Реактивное движение. Уравнение Мещерского.
- •Решение
- •Решение
- •§1.16. Преобразование скорости и ускорения
- •§1.17. Неинерциальные системы отсчета. Силы инерции.
- •§1.18. Силы инерции.
- •§1.19. Особенности сил инерции.
- •§1.20. Принцип эквивалентности.
- •§1.21. Закон сохранения энергии.
- •§1.22. Связь между кинетическими энергиями в различных системах отсчета.
- •§1.23. Энергия движения тела как целого.
- •§1.24. Потенциальная энергия.
- •§1.25. Законы сохранения и симметрия пространства.
- •§1.26. Графическое представление энергии.
- •§1.27. Элементы механики твердого тела.
- •§1.28. Момент инерции диска. Теорема Штейнера
- •§1.29. Момент силы
- •§1.30. Работа при вращательном движении.
- •§1.31. Момент импульса. Закон сохранения момента импульса.
- •§1.32. Условия равновесия твердого тела.
- •§1.33. Принцип относительности в механике. Инерциальные системы отсчёта и принцип относительности. Преобразования Галилея.
- •§1.34. Постулаты специальной теории относительности.
- •§1.35. Следствия из преобразований Лоренца.
- •§1.36. Элементы релятивистской динамики.
- •§1.37. Работа и энергия. Законы сохранения энергии и импульса.
- •§1.38. Механика колебаний и волн.
- •§1.39. Векторные диаграммы.
- •§1.40. Комплексная форма представления колебаний
- •§1.41. Сложение гармонических колебаний.
- •§1.42. Биения
- •§1.43. Кинетическая и потенциальная энергия при гармонических механических колебаниях.
- •§1.44. Гармонический осциллятор.
- •§1.45.Свободные и затухающие колебания.
- •§1.46. Вынужденные колебания осциллятора под действием синусоидальной силы.
- •§1.47. Волновые процессы.
- •§1.48. Эффект Доплера.
- •§1.49. Групповая скорость и её связь
- •§1.50. Одномерное волновое уравнение.
- •Глава II. Статистическая физика и термодинамика.
- •§2.1. Динамические и статистические закономерности в физике. Статистический и термодинамический методы.
- •§2.2. Макроскопические состояния.
- •§2.3. Уравнение состояния идеального газа.
- •§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
- •§2.5. Молекулярно-кинетический смысл температуры.
- •§2.6. Статистические распределения.
- •§2.7.Скорости теплового движения частиц. Распределение частиц по абсолютным значениям скорости.
- •§2.8.Средняя кинетическая энергия частицы.
- •§2.9.Распределение Больцмана.
- •§2.10. Явления переноса. Понятие о физической кинетике.
- •§2.11. Эффективное сечение. Длина свободного пробега.
- •§2.12. Явления переноса.
- •§2.13. Теплопроводность.
- •§2.14. Диффузия.
- •§2.15. Внутреннее трение (вязкость).
- •§2.16. Основы термодинамики.
- •§2.17. Работа газа при изменении
- •§2.18. Эквивалентность теплоты и работы.
- •§2.19. Первое начало термодинамики.
- •§2.20. Теплоёмкость многоатомных газов.
- •§2.21. Применение первого начала термодинамики
- •§2.22. Работа в адиабатическом процессе.
- •§2.23. Энтропия.
- •§2.24. Изменение энтропии в изопроцессах.
- •4) Адиабатный.
- •§2.25. Связь энтропии с вероятностью состояния системы. Принцип возрастания энтропии.
- •§2.26. Свойства энтропии.
- •§2.27. Вычисление и применение энтропии.
- •§2.28. Цикл Карно.
- •§2.29. Второе начало термодинамики.
- •По Кельвину:
- •По Клаузиусу:
- •§2.30. Цикл Карно. Максимальный кпд тепловой машины.
- •§2.31. Фазовые равновесия и фазовые превращения. Фазы и фазовые превращения.
- •§2.32. Фазовые переходы I рода.
- •§2.33. Фазовые переходы II рода
- •§2.34. Условия равновесия фаз. Фазовые диаграммы.
- •§2.35. Метастабильные состояния.
- •§2.36. Реальные газы. Уравнение Ван-дер-Ваальса.
- •1) Учёт собственного объёма молекул.
- •2) Учёт притяжения молекул.
- •V метастабильные состояния Резюме
- •Оглавление
- •1.1. Элементы кинематики
- •1.2. Элементы динамики частиц
- •1.3. Законы сохранения импульса и механической энергии
- •1.4. Элементы механики твердого тела
- •1.5. Принцип относительности Галилея
- •1.6. Элементы релятивистской динамики
- •2. Механика колебаний и волн
- •2.1. Кинематика гармонических колебаний
- •2.2. Гармонический осциллятор
- •2.3. Волновые процессы
- •3. Статистическая физика и термодинамика
- •3.5. Реальные газы, жидкости и кристаллы
§2.34. Условия равновесия фаз. Фазовые диаграммы.
Для наглядного представления фазовых превращений используется диаграмма, на которой в координатах Р-Т задаётся зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ - кривая испарения), плавления (КП -кривая плавления) и сублимации (КС - кривая сублимации). Эти зависимости делят поле диаграммы на три области, соответствующие условиям существования твёрдой (ТТ - твёрдое тело), жидкой (Ж) и газообразной (Г) фаз.
Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП – твёрдого тела и жидкости, КИ – жидкости и газа, КС – твёрдого тела и газа.

Тройная точка – точка, в которой пересекаются эти кривые и которая определяет условия (Ттр и Ртр) одновременного равновесного сосуществования трёх фаз вещества. Каждое вещество имеет только одну тройную точку (для воды это 273.16°К или 0.01°С).
Термодинамика позволяет рассчитать условия равновесия двух фаз одного и того же вещества.
 уравнение
Клапейрона-Клаузиуса.
уравнение
Клапейрона-Клаузиуса.
Q – теплота фазового перехода.
(V2 – V1) – изменение объёма вещества при переходе его первой фазы во вторую.
Т – температура перехода (процесс изотермический).
Уравнение Клапейрона-Клаузиуса позволяет определить наклоны кривых равновесия. Т.к. Q и T положительны, наклон задаётся знаком (V2 - V1).
При испарении
жидкостей и сублимации Т.Т. объём вещества
всегда возрастает, поэтому
![]() > 0 и в этих процессах рост Т
приводит к росту Р и наоборот.
> 0 и в этих процессах рост Т
приводит к росту Р и наоборот.
При плавлении
большинства веществ объём, как правило,
возрастает, т.е.
![]() > 0, следовательно рост Р
приводит к повышению температуры
плавления Т.
Для некоторых веществ (вода, Ge,
чугун и др.) объём жидкой фазы меньше
объёма твёрдой фазы
> 0, следовательно рост Р
приводит к повышению температуры
плавления Т.
Для некоторых веществ (вода, Ge,
чугун и др.) объём жидкой фазы меньше
объёма твёрдой фазы
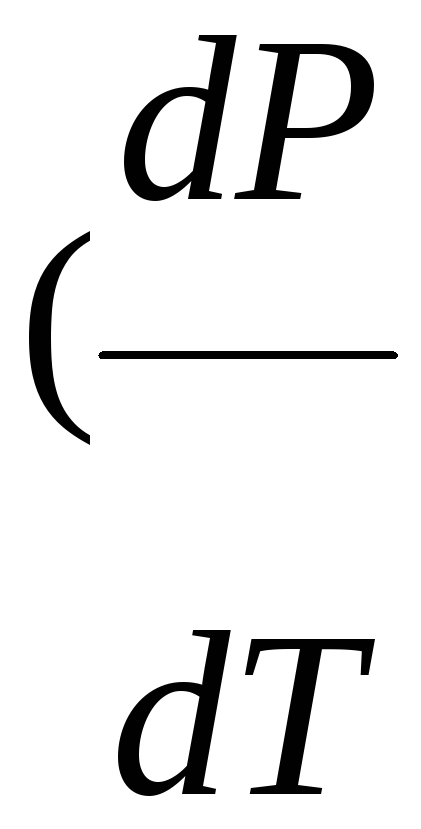 < 0
< 0![]() ,
следовательно увеличение давления
приводит к понижению температуры
плавления.
,
следовательно увеличение давления
приводит к понижению температуры
плавления.
§2.35. Метастабильные состояния.
Для кристаллизации вещества необходимо наличие центров кристаллизации – кристаллических зародышей, которыми могут быть не только кристаллики основного вещества, но и примеси, а также пыль, сажа и т.д.
Отсутствие центров кристаллизации в чистой жидкости затрудняет образование макроскопических кристаллов и вещество, оставаясь в жидком состоянии, можно охладить до температуры ниже температуры кристаллизации. При этом образуется переохлаждённая жидкость, это метастабильное (неустойчивое) состояние вещества.
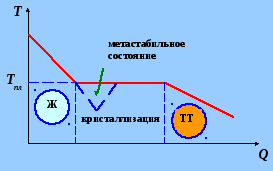
Аналогичное явление может наблюдаться при кипении жидкости. Хорошо очищенная жидкость (без газа, пыли, сажи и т.д.) может быть нагрета до температуры выше температуры кипения, это – перегретая жидкость, представляющая также метастабильное состояние вещества.


§2.36. Реальные газы. Уравнение Ван-дер-Ваальса.
Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому уравнение Менделеева-Клапейрона для реальных газов непригодно.
Собственный объём молекул и силы межмолекулярного взаимодействия учитывает уравнение Ван-дер-Ваальса.
Уравнение Менделеева-Клапейрона PVm = RT (для 1 моля газа).
В него внесены два исправления:
