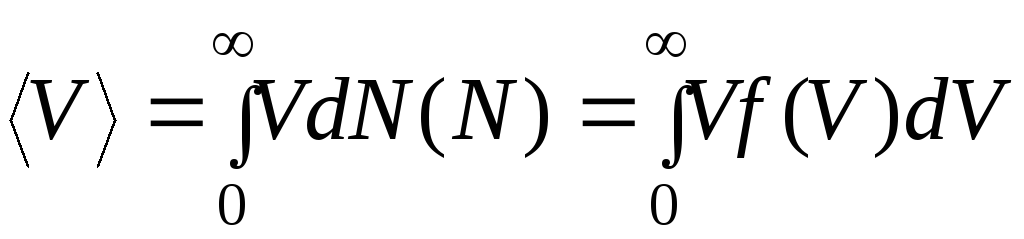- •Глава I. Физические основы динамики.
- •§1.1. Предмет механики. Кинематика и динамика. Классическая механика. Квантовая механика. Релятивистская механика.
- •§1.2. Силы.
- •§1.3. Элементы кинематики.
- •§1.4. Пространство и время.
- •§1.5. Кинематическое описание движения.
- •§1.6. Вектор перемещения. Скорость. Ускорение.
- •§1.7. Движение точки по окружности.
- •§1.8. Линейная скорость точки.
- •§1.9. Связь между угловыми и линейными параметрами движения.
- •Решение:
- •§1.10. Элементы динамики поступательного движения. Основная задача динамики. Понятие состояния в классической механике. Масса, импульс, сила.
- •§1.11. Современная трактовка законов Ньютона.
- •§1.12. Второй закон Ньютона как уравнение движения импульса.
- •§1.13. Третий закон Ньютона.
- •§1.14. Закон сохранения импульса.
- •§1.15. Реактивное движение. Уравнение Мещерского.
- •Решение
- •Решение
- •§1.16. Преобразование скорости и ускорения
- •§1.17. Неинерциальные системы отсчета. Силы инерции.
- •§1.18. Силы инерции.
- •§1.19. Особенности сил инерции.
- •§1.20. Принцип эквивалентности.
- •§1.21. Закон сохранения энергии.
- •§1.22. Связь между кинетическими энергиями в различных системах отсчета.
- •§1.23. Энергия движения тела как целого.
- •§1.24. Потенциальная энергия.
- •§1.25. Законы сохранения и симметрия пространства.
- •§1.26. Графическое представление энергии.
- •§1.27. Элементы механики твердого тела.
- •§1.28. Момент инерции диска. Теорема Штейнера
- •§1.29. Момент силы
- •§1.30. Работа при вращательном движении.
- •§1.31. Момент импульса. Закон сохранения момента импульса.
- •§1.32. Условия равновесия твердого тела.
- •§1.33. Принцип относительности в механике. Инерциальные системы отсчёта и принцип относительности. Преобразования Галилея.
- •§1.34. Постулаты специальной теории относительности.
- •§1.35. Следствия из преобразований Лоренца.
- •§1.36. Элементы релятивистской динамики.
- •§1.37. Работа и энергия. Законы сохранения энергии и импульса.
- •§1.38. Механика колебаний и волн.
- •§1.39. Векторные диаграммы.
- •§1.40. Комплексная форма представления колебаний
- •§1.41. Сложение гармонических колебаний.
- •§1.42. Биения
- •§1.43. Кинетическая и потенциальная энергия при гармонических механических колебаниях.
- •§1.44. Гармонический осциллятор.
- •§1.45.Свободные и затухающие колебания.
- •§1.46. Вынужденные колебания осциллятора под действием синусоидальной силы.
- •§1.47. Волновые процессы.
- •§1.48. Эффект Доплера.
- •§1.49. Групповая скорость и её связь
- •§1.50. Одномерное волновое уравнение.
- •Глава II. Статистическая физика и термодинамика.
- •§2.1. Динамические и статистические закономерности в физике. Статистический и термодинамический методы.
- •§2.2. Макроскопические состояния.
- •§2.3. Уравнение состояния идеального газа.
- •§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
- •§2.5. Молекулярно-кинетический смысл температуры.
- •§2.6. Статистические распределения.
- •§2.7.Скорости теплового движения частиц. Распределение частиц по абсолютным значениям скорости.
- •§2.8.Средняя кинетическая энергия частицы.
- •§2.9.Распределение Больцмана.
- •§2.10. Явления переноса. Понятие о физической кинетике.
- •§2.11. Эффективное сечение. Длина свободного пробега.
- •§2.12. Явления переноса.
- •§2.13. Теплопроводность.
- •§2.14. Диффузия.
- •§2.15. Внутреннее трение (вязкость).
- •§2.16. Основы термодинамики.
- •§2.17. Работа газа при изменении
- •§2.18. Эквивалентность теплоты и работы.
- •§2.19. Первое начало термодинамики.
- •§2.20. Теплоёмкость многоатомных газов.
- •§2.21. Применение первого начала термодинамики
- •§2.22. Работа в адиабатическом процессе.
- •§2.23. Энтропия.
- •§2.24. Изменение энтропии в изопроцессах.
- •4) Адиабатный.
- •§2.25. Связь энтропии с вероятностью состояния системы. Принцип возрастания энтропии.
- •§2.26. Свойства энтропии.
- •§2.27. Вычисление и применение энтропии.
- •§2.28. Цикл Карно.
- •§2.29. Второе начало термодинамики.
- •По Кельвину:
- •По Клаузиусу:
- •§2.30. Цикл Карно. Максимальный кпд тепловой машины.
- •§2.31. Фазовые равновесия и фазовые превращения. Фазы и фазовые превращения.
- •§2.32. Фазовые переходы I рода.
- •§2.33. Фазовые переходы II рода
- •§2.34. Условия равновесия фаз. Фазовые диаграммы.
- •§2.35. Метастабильные состояния.
- •§2.36. Реальные газы. Уравнение Ван-дер-Ваальса.
- •1) Учёт собственного объёма молекул.
- •2) Учёт притяжения молекул.
- •V метастабильные состояния Резюме
- •Оглавление
- •1.1. Элементы кинематики
- •1.2. Элементы динамики частиц
- •1.3. Законы сохранения импульса и механической энергии
- •1.4. Элементы механики твердого тела
- •1.5. Принцип относительности Галилея
- •1.6. Элементы релятивистской динамики
- •2. Механика колебаний и волн
- •2.1. Кинематика гармонических колебаний
- •2.2. Гармонический осциллятор
- •2.3. Волновые процессы
- •3. Статистическая физика и термодинамика
- •3.5. Реальные газы, жидкости и кристаллы
§2.6. Статистические распределения.
Вероятность и флуктуации.
Молекулы (если это газ) хаотически двигаются, в результате этого происходят значительные случайные отклонения от равновесного распределения молекул по объёму сосуда. Поэтому плотность газа в различных местах может отличаться от средней плотности. Точно так же могут происходить случайные отклонения температуры, давления, скорости молекул и других физических величин от их средних значений.
Подобные явления называются флуктуациями соответствующих величин. Флуктуации обусловлены тепловым движением частиц образующих макроскопическую систему. Чем больше этих частиц, тем меньше относительные флуктуации термодинамических параметров этой системы.
Относительная флуктуация δ величины L

![]()
![]() ,
,
где δL – абсолютная флуктуация.
![]() среднее
отклонение L
от среднего значения
среднее
отклонение L
от среднего значения
![]() .
.
В химически
однородном идеальном газе относительные
флуктуации плотности, давления и
температуры обратно пропорциональны
![]() (N
– число молекул)т.е.
(N
– число молекул)т.е.
![]() ~
~
![]() ~
~
![]() ~
~
![]() ≈ 1,3 · 10-12
≈ 1,3 ·
10-10
% если N
= NA
≈ 1,3 · 10-12
≈ 1,3 ·
10-10
% если N
= NA
Пусть некоторая величина х, характеризующая молекулу, принимает ряд дискретных значений х1, х2, …, хi,…. Если бы удалось измерить одновременно значение величины х у всех N молекул, то оказалось бы, что значение х1, имеет N1 молекул, х2 – N2, и т.д. хi – Ni – молекул.
Величина
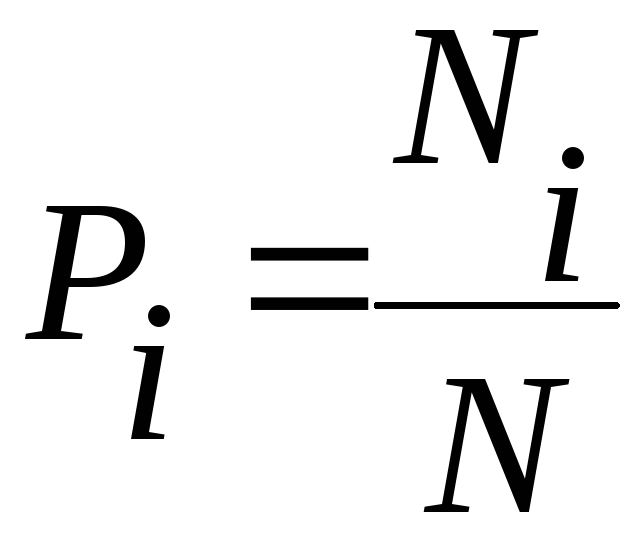 называется вероятностью того, что
величина х
имеет значение хi.
называется вероятностью того, что
величина х
имеет значение хi.
Такое определение вероятности пригодно лишь в случае очень больших N. Очевидно, что
![]() поэтому
поэтому
![]()
Если величина х принимает непрерывный ряд значений от х = a до х = b, то можно ввести понятие вероятности dPx того, что величина х имеет значения, заключённые в пределах интервала dx, расположенного в окрестности значения х.
Эта вероятность является функцией х:
dPx = f(x)dx.
Функция f(x)
называется функцией распределения
вероятности или плотностью распределения
вероятности. Среднее значение
![]() (например).
(например).
![]()
или
![]()
§2.7.Скорости теплового движения частиц. Распределение частиц по абсолютным значениям скорости.
Распределение Максвелла.
Как бы ни изменялись
скорости молекул при столкновениях,
средняя квадратичная скорость
![]() молекул массой m0
в газе в состоянии равновесия при T
= const
остаётся постоянной и равна
молекул массой m0
в газе в состоянии равновесия при T
= const
остаётся постоянной и равна

В состоянии равновесия устанавливается некоторое стационарное не меняющееся со временем распределение молекул по скоростям, подчиняющееся определенному статистическому закону. Этот закон теоретически выведен Максвеллом.
Предполагается, что газ состоит из очень большого числа N тождественных молекул в состоянии хаотического теплового движения при одинаковой температуре. Силовые поля на газ не действуют.
Закон Максвелла
описывается некоторой функцией f(V),
называемой функцией распределения
молекул по скоростям. Скорость молекул,
заключённая в интервале dV,
определяет функция f(V),
показывающая относительное число
молекул
 скорости которых лежат в интервале от
V
до V
+ dV
скорости которых лежат в интервале от
V
до V
+ dV
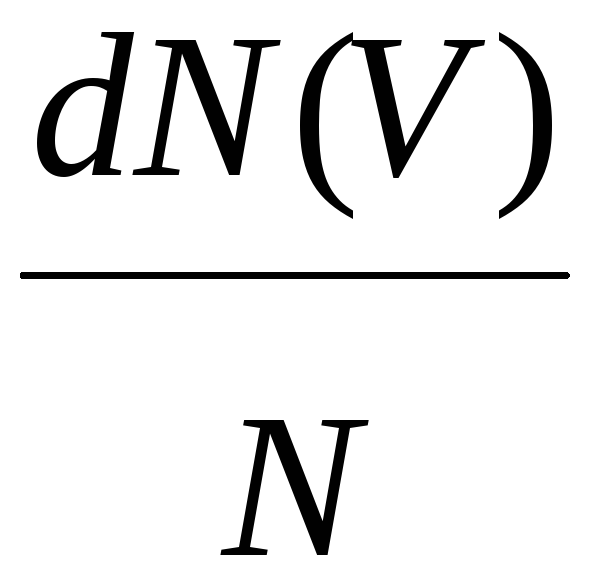 = f(V)dV
= f(V)dV
т.е.

Функция распределения Максвелла имеет вид
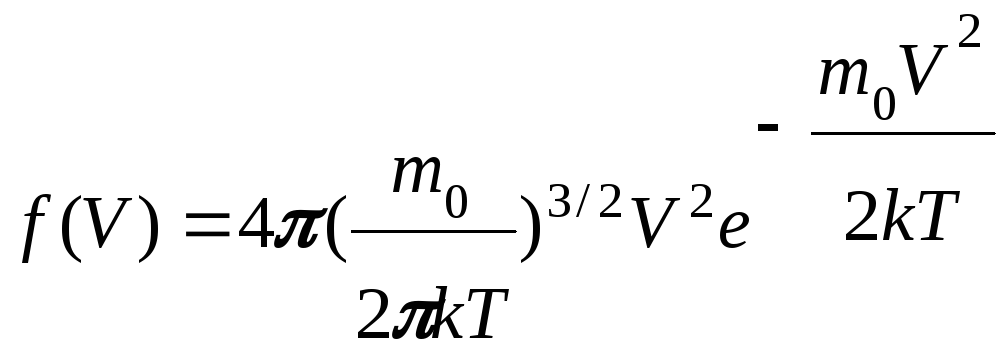
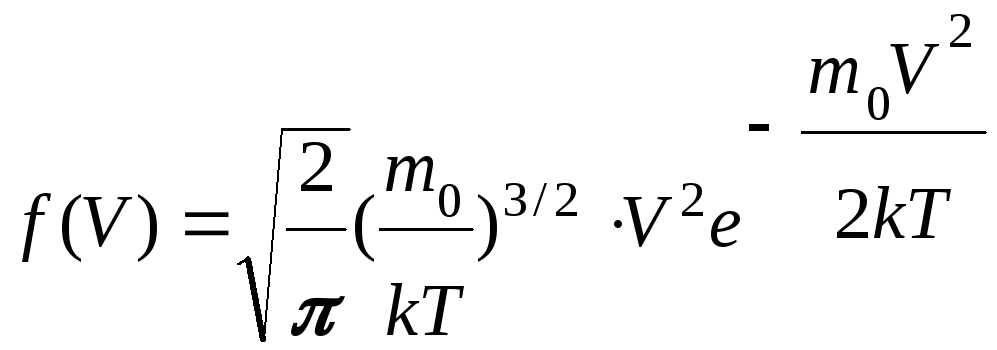
f(V) V O












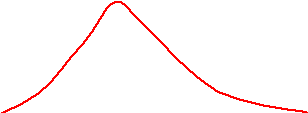

Функция достигает максимума при V = Vв – наиболее вероятной скорости:

 µ -
молекулярный вес.
µ -
молекулярный вес.
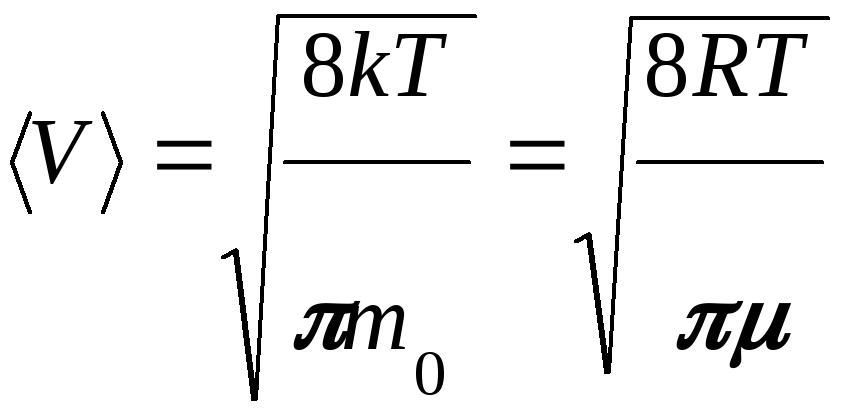
Средняя скорость
молекулы
![]() (средняя арифметическая скорость).
(средняя арифметическая скорость).