
- •Глава I. Физические основы динамики.
- •§1.1. Предмет механики. Кинематика и динамика. Классическая механика. Квантовая механика. Релятивистская механика.
- •§1.2. Силы.
- •§1.3. Элементы кинематики.
- •§1.4. Пространство и время.
- •§1.5. Кинематическое описание движения.
- •§1.6. Вектор перемещения. Скорость. Ускорение.
- •§1.7. Движение точки по окружности.
- •§1.8. Линейная скорость точки.
- •§1.9. Связь между угловыми и линейными параметрами движения.
- •Решение:
- •§1.10. Элементы динамики поступательного движения. Основная задача динамики. Понятие состояния в классической механике. Масса, импульс, сила.
- •§1.11. Современная трактовка законов Ньютона.
- •§1.12. Второй закон Ньютона как уравнение движения импульса.
- •§1.13. Третий закон Ньютона.
- •§1.14. Закон сохранения импульса.
- •§1.15. Реактивное движение. Уравнение Мещерского.
- •Решение
- •Решение
- •§1.16. Преобразование скорости и ускорения
- •§1.17. Неинерциальные системы отсчета. Силы инерции.
- •§1.18. Силы инерции.
- •§1.19. Особенности сил инерции.
- •§1.20. Принцип эквивалентности.
- •§1.21. Закон сохранения энергии.
- •§1.22. Связь между кинетическими энергиями в различных системах отсчета.
- •§1.23. Энергия движения тела как целого.
- •§1.24. Потенциальная энергия.
- •§1.25. Законы сохранения и симметрия пространства.
- •§1.26. Графическое представление энергии.
- •§1.27. Элементы механики твердого тела.
- •§1.28. Момент инерции диска. Теорема Штейнера
- •§1.29. Момент силы
- •§1.30. Работа при вращательном движении.
- •§1.31. Момент импульса. Закон сохранения момента импульса.
- •§1.32. Условия равновесия твердого тела.
- •§1.33. Принцип относительности в механике. Инерциальные системы отсчёта и принцип относительности. Преобразования Галилея.
- •§1.34. Постулаты специальной теории относительности.
- •§1.35. Следствия из преобразований Лоренца.
- •§1.36. Элементы релятивистской динамики.
- •§1.37. Работа и энергия. Законы сохранения энергии и импульса.
- •§1.38. Механика колебаний и волн.
- •§1.39. Векторные диаграммы.
- •§1.40. Комплексная форма представления колебаний
- •§1.41. Сложение гармонических колебаний.
- •§1.42. Биения
- •§1.43. Кинетическая и потенциальная энергия при гармонических механических колебаниях.
- •§1.44. Гармонический осциллятор.
- •§1.45.Свободные и затухающие колебания.
- •§1.46. Вынужденные колебания осциллятора под действием синусоидальной силы.
- •§1.47. Волновые процессы.
- •§1.48. Эффект Доплера.
- •§1.49. Групповая скорость и её связь
- •§1.50. Одномерное волновое уравнение.
- •Глава II. Статистическая физика и термодинамика.
- •§2.1. Динамические и статистические закономерности в физике. Статистический и термодинамический методы.
- •§2.2. Макроскопические состояния.
- •§2.3. Уравнение состояния идеального газа.
- •§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
- •§2.5. Молекулярно-кинетический смысл температуры.
- •§2.6. Статистические распределения.
- •§2.7.Скорости теплового движения частиц. Распределение частиц по абсолютным значениям скорости.
- •§2.8.Средняя кинетическая энергия частицы.
- •§2.9.Распределение Больцмана.
- •§2.10. Явления переноса. Понятие о физической кинетике.
- •§2.11. Эффективное сечение. Длина свободного пробега.
- •§2.12. Явления переноса.
- •§2.13. Теплопроводность.
- •§2.14. Диффузия.
- •§2.15. Внутреннее трение (вязкость).
- •§2.16. Основы термодинамики.
- •§2.17. Работа газа при изменении
- •§2.18. Эквивалентность теплоты и работы.
- •§2.19. Первое начало термодинамики.
- •§2.20. Теплоёмкость многоатомных газов.
- •§2.21. Применение первого начала термодинамики
- •§2.22. Работа в адиабатическом процессе.
- •§2.23. Энтропия.
- •§2.24. Изменение энтропии в изопроцессах.
- •4) Адиабатный.
- •§2.25. Связь энтропии с вероятностью состояния системы. Принцип возрастания энтропии.
- •§2.26. Свойства энтропии.
- •§2.27. Вычисление и применение энтропии.
- •§2.28. Цикл Карно.
- •§2.29. Второе начало термодинамики.
- •По Кельвину:
- •По Клаузиусу:
- •§2.30. Цикл Карно. Максимальный кпд тепловой машины.
- •§2.31. Фазовые равновесия и фазовые превращения. Фазы и фазовые превращения.
- •§2.32. Фазовые переходы I рода.
- •§2.33. Фазовые переходы II рода
- •§2.34. Условия равновесия фаз. Фазовые диаграммы.
- •§2.35. Метастабильные состояния.
- •§2.36. Реальные газы. Уравнение Ван-дер-Ваальса.
- •1) Учёт собственного объёма молекул.
- •2) Учёт притяжения молекул.
- •V метастабильные состояния Резюме
- •Оглавление
- •1.1. Элементы кинематики
- •1.2. Элементы динамики частиц
- •1.3. Законы сохранения импульса и механической энергии
- •1.4. Элементы механики твердого тела
- •1.5. Принцип относительности Галилея
- •1.6. Элементы релятивистской динамики
- •2. Механика колебаний и волн
- •2.1. Кинематика гармонических колебаний
- •2.2. Гармонический осциллятор
- •2.3. Волновые процессы
- •3. Статистическая физика и термодинамика
- •3.5. Реальные газы, жидкости и кристаллы
§2.20. Теплоёмкость многоатомных газов.
Удельная теплоёмкость
 (единица массы
вещества)
(единица массы
вещества)
Молярная теплоёмкость –

 (1моль вещества)
(1моль вещества)
Различают теплоёмкости при постоянном объёме и постоянном давлении, если в процессе нагревания вещества его объём или давление остаётся постоянным. Для одного моля газа

Из первого начала Т.Д. имеем:
Cm · dT =dUm + РdVm
при V = const → Cm dT = CV · dT = dUm
 .
.
Для произвольной массы газа
 ,
,
следовательно


при P = const
![]() откуда
откуда
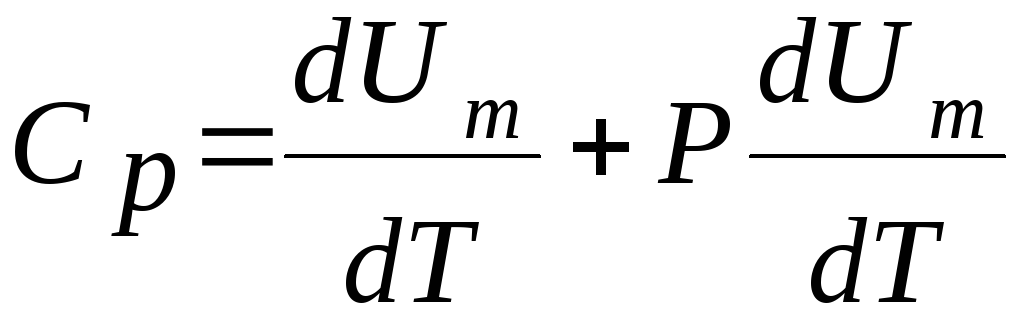 но
но

 .
.
Из уравнения Менделеева-Клапейрона

откуда
CP = CV + R – уравнение Майера.
но т.к.
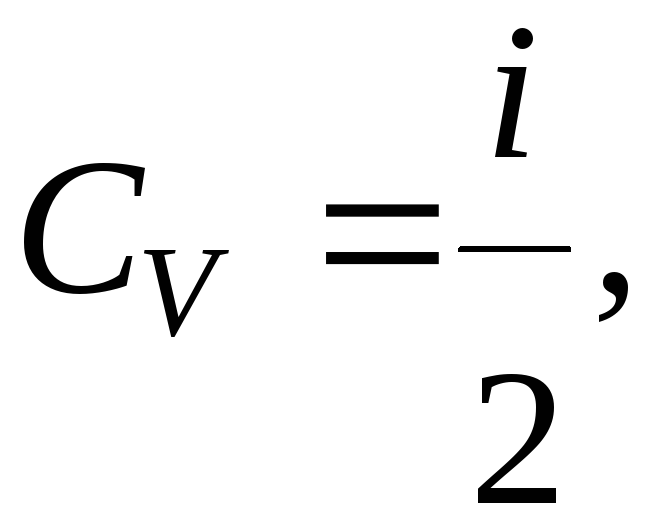 то
то

 коэффициент
Пуассона.
коэффициент
Пуассона.
СP и СV не зависят от температуры, а определяются лишь числом степеней свободы. Это утверждение МКТ справедливо в довольно широком интервале температур лишь для одноатомных газов.
Уже для двухатомных газов число степеней свободы зависит от температуры.
Для двухатомной молекулы есть три поступательных, две вращательных и одна колебательная степень свободы (на колебательную степень свободы приходится 2 степени свободы – потенциальная и кинетическая энергии).
По закону равномерного
распределения энергии по степеням
свободы для комнатных температур
 Эксперимент даёт для молекулы водорода
Н2
следующую зависимость
Эксперимент даёт для молекулы водорода
Н2
следующую зависимость

При низких
температурах наблюдается только
поступательное движение (колебательные
и
 вращательные степени свободы ,,выморожены”)
при более высоких температурах добавляется
вращение, а при высоких ещё и колебания
молекул.
вращательные степени свободы ,,выморожены”)
при более высоких температурах добавляется
вращение, а при высоких ещё и колебания
молекул.
Расхождение теории и эксперимента объясняется квантованием колебательной и вращательной энергии. Если энергия теплового движения недостаточна для возбуждения колебаний, то эти колебания не вносят вклада в теплоёмкость, соответствующая степень свободы ,,замораживается” и к ней неприменим закон о распределении энергии. Аналогично можно объяснить уменьшение теплоёмкости при низкой температуре - ,,замораживается” вращательные степени свободы.
В этом – недостатки классической теории теплоёмкости.
§2.21. Применение первого начала термодинамики
к изопроцессам и к адиабатическому процессу.
-
Изохорный процесс (V = const).

![]()
dQ = dU но dUm = CVdT
тогда для произвольной массы газа

2) Изобарный процесс (P = const).


из основного
уравнения МКT


откуда
 dQ
= dU
+ P∆V
dQ
= dU
+ P∆V

-
Изотермический процесс (T = const).
dT = 0→



=

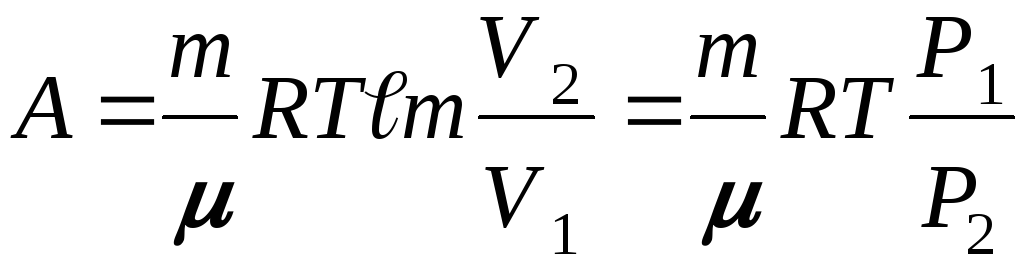
т.е. при T = const
![]()
или

-
Адиабатический процесс (δQ = 0).
δА = -dU
т.к. δА
= - dU,
а
 или
или

имеем

из основного уравнения МКТ

имеем

разделив (2) на (1) имеем

но

откуда


интегрируя получаем
![]()
![]() уравнение адиабаты
(уравнение Пуассона).
уравнение адиабаты
(уравнение Пуассона).
Используя уравнение Менделеева-Клайперона из уравнения Пуассона можно также получить:
![]()
![]()
§2.22. Работа в адиабатическом процессе.

![]() где
где

![]()

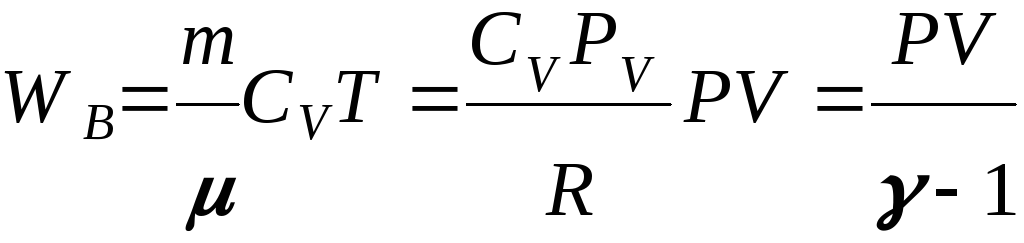
![]()


PVγ
= const


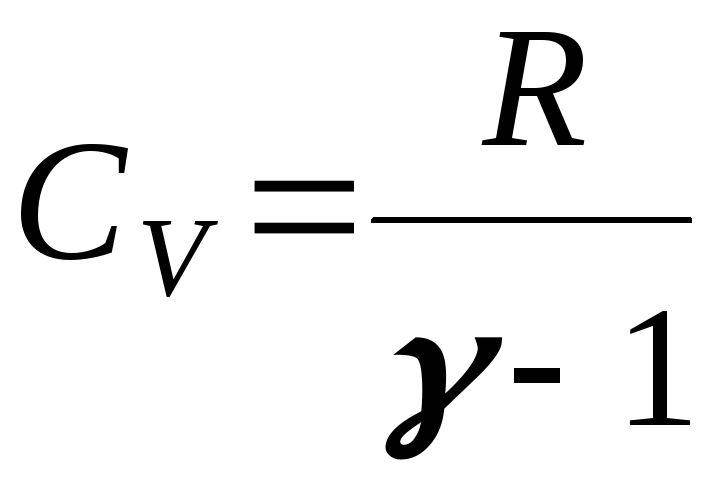

C V=
dU
V=
dU

i(γ -1)
T2V2γ-1 = T1V1
 TVγ-1
= const
TVγ-1
= const
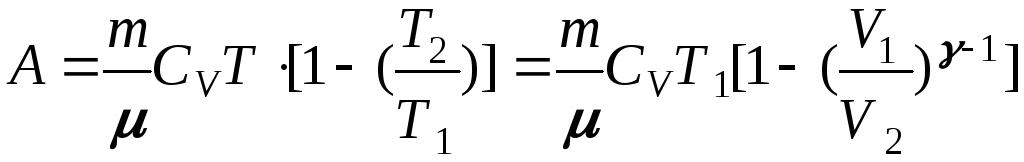


учитывая, что
 можно
получить
можно
получить
TVγ-1 = const
Tγ P1-γ = const γ – показатель адиабаты.

Работа в адиабатическом процессе будет



Это выражение можно преобразовать к виду

