
- •Глава I. Физические основы динамики.
- •§1.1. Предмет механики. Кинематика и динамика. Классическая механика. Квантовая механика. Релятивистская механика.
- •§1.2. Силы.
- •§1.3. Элементы кинематики.
- •§1.4. Пространство и время.
- •§1.5. Кинематическое описание движения.
- •§1.6. Вектор перемещения. Скорость. Ускорение.
- •§1.7. Движение точки по окружности.
- •§1.8. Линейная скорость точки.
- •§1.9. Связь между угловыми и линейными параметрами движения.
- •Решение:
- •§1.10. Элементы динамики поступательного движения. Основная задача динамики. Понятие состояния в классической механике. Масса, импульс, сила.
- •§1.11. Современная трактовка законов Ньютона.
- •§1.12. Второй закон Ньютона как уравнение движения импульса.
- •§1.13. Третий закон Ньютона.
- •§1.14. Закон сохранения импульса.
- •§1.15. Реактивное движение. Уравнение Мещерского.
- •Решение
- •Решение
- •§1.16. Преобразование скорости и ускорения
- •§1.17. Неинерциальные системы отсчета. Силы инерции.
- •§1.18. Силы инерции.
- •§1.19. Особенности сил инерции.
- •§1.20. Принцип эквивалентности.
- •§1.21. Закон сохранения энергии.
- •§1.22. Связь между кинетическими энергиями в различных системах отсчета.
- •§1.23. Энергия движения тела как целого.
- •§1.24. Потенциальная энергия.
- •§1.25. Законы сохранения и симметрия пространства.
- •§1.26. Графическое представление энергии.
- •§1.27. Элементы механики твердого тела.
- •§1.28. Момент инерции диска. Теорема Штейнера
- •§1.29. Момент силы
- •§1.30. Работа при вращательном движении.
- •§1.31. Момент импульса. Закон сохранения момента импульса.
- •§1.32. Условия равновесия твердого тела.
- •§1.33. Принцип относительности в механике. Инерциальные системы отсчёта и принцип относительности. Преобразования Галилея.
- •§1.34. Постулаты специальной теории относительности.
- •§1.35. Следствия из преобразований Лоренца.
- •§1.36. Элементы релятивистской динамики.
- •§1.37. Работа и энергия. Законы сохранения энергии и импульса.
- •§1.38. Механика колебаний и волн.
- •§1.39. Векторные диаграммы.
- •§1.40. Комплексная форма представления колебаний
- •§1.41. Сложение гармонических колебаний.
- •§1.42. Биения
- •§1.43. Кинетическая и потенциальная энергия при гармонических механических колебаниях.
- •§1.44. Гармонический осциллятор.
- •§1.45.Свободные и затухающие колебания.
- •§1.46. Вынужденные колебания осциллятора под действием синусоидальной силы.
- •§1.47. Волновые процессы.
- •§1.48. Эффект Доплера.
- •§1.49. Групповая скорость и её связь
- •§1.50. Одномерное волновое уравнение.
- •Глава II. Статистическая физика и термодинамика.
- •§2.1. Динамические и статистические закономерности в физике. Статистический и термодинамический методы.
- •§2.2. Макроскопические состояния.
- •§2.3. Уравнение состояния идеального газа.
- •§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
- •§2.5. Молекулярно-кинетический смысл температуры.
- •§2.6. Статистические распределения.
- •§2.7.Скорости теплового движения частиц. Распределение частиц по абсолютным значениям скорости.
- •§2.8.Средняя кинетическая энергия частицы.
- •§2.9.Распределение Больцмана.
- •§2.10. Явления переноса. Понятие о физической кинетике.
- •§2.11. Эффективное сечение. Длина свободного пробега.
- •§2.12. Явления переноса.
- •§2.13. Теплопроводность.
- •§2.14. Диффузия.
- •§2.15. Внутреннее трение (вязкость).
- •§2.16. Основы термодинамики.
- •§2.17. Работа газа при изменении
- •§2.18. Эквивалентность теплоты и работы.
- •§2.19. Первое начало термодинамики.
- •§2.20. Теплоёмкость многоатомных газов.
- •§2.21. Применение первого начала термодинамики
- •§2.22. Работа в адиабатическом процессе.
- •§2.23. Энтропия.
- •§2.24. Изменение энтропии в изопроцессах.
- •4) Адиабатный.
- •§2.25. Связь энтропии с вероятностью состояния системы. Принцип возрастания энтропии.
- •§2.26. Свойства энтропии.
- •§2.27. Вычисление и применение энтропии.
- •§2.28. Цикл Карно.
- •§2.29. Второе начало термодинамики.
- •По Кельвину:
- •По Клаузиусу:
- •§2.30. Цикл Карно. Максимальный кпд тепловой машины.
- •§2.31. Фазовые равновесия и фазовые превращения. Фазы и фазовые превращения.
- •§2.32. Фазовые переходы I рода.
- •§2.33. Фазовые переходы II рода
- •§2.34. Условия равновесия фаз. Фазовые диаграммы.
- •§2.35. Метастабильные состояния.
- •§2.36. Реальные газы. Уравнение Ван-дер-Ваальса.
- •1) Учёт собственного объёма молекул.
- •2) Учёт притяжения молекул.
- •V метастабильные состояния Резюме
- •Оглавление
- •1.1. Элементы кинематики
- •1.2. Элементы динамики частиц
- •1.3. Законы сохранения импульса и механической энергии
- •1.4. Элементы механики твердого тела
- •1.5. Принцип относительности Галилея
- •1.6. Элементы релятивистской динамики
- •2. Механика колебаний и волн
- •2.1. Кинематика гармонических колебаний
- •2.2. Гармонический осциллятор
- •2.3. Волновые процессы
- •3. Статистическая физика и термодинамика
- •3.5. Реальные газы, жидкости и кристаллы
§2.3. Уравнение состояния идеального газа.
Уравнение состояния – устанавливает связь между параметрами состояния. В простейшем случае равновесное состояние тела определяется P, V, T. Связь между ними аналитически можно выразить так:
F(P, V, T) = 0
где F – некоторая функция параметров.
Это - уравнение состояния газа.
При обычных условиях параметры состояния многих газов хорошо описываются уравнением
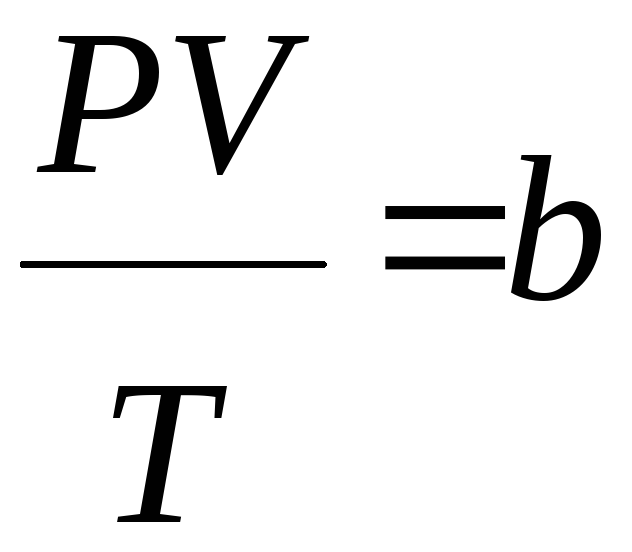
где b – константа, пропорциональная массе газа.
Это уравнение выполняется точно для идеального газа.
Идеальный газ – газ, молекулы которого не взаимодействуют друг с другом и имеют пренебрежимо малый объём. Молекулы соударяются друг с другом абсолютно упруго.
Если ввести молярный
объём
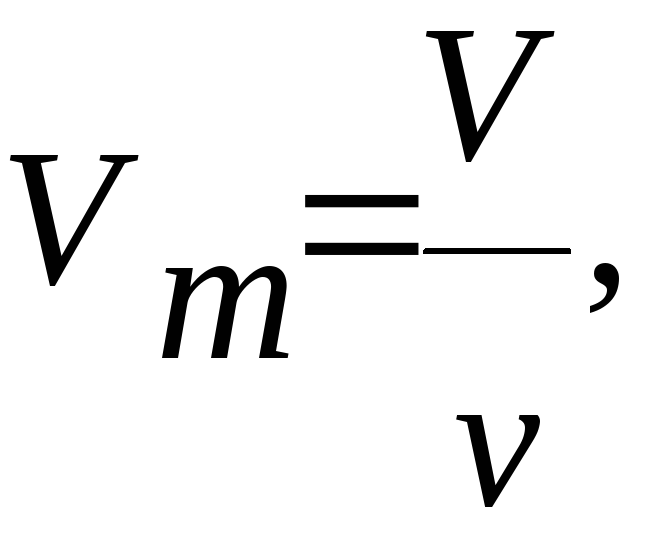 где ν
– количество вещества и учесть , что
где ν
– количество вещества и учесть , что
m = m0NAν =µν
где m0 – масса одной молекулы.
µ - молекулярная масса.
NA – число Авогадро,
то уравнение состояния можно записать в виде
р Vm ν = b · T или PVm = RT *
Согласно закону Авогадро при одинаковых давлениях и температурах молярные объёмы Vm различных газов одинаковы.(Vm = 22.4·10-3м3) при Н.У.
Из этого закона и уравнения * следует, что постоянная R одинакова для всех газов. Это - универсальная газовая постоянная R = 8.31 Дж/(моль۰К)
Для произвольной массы газа
* *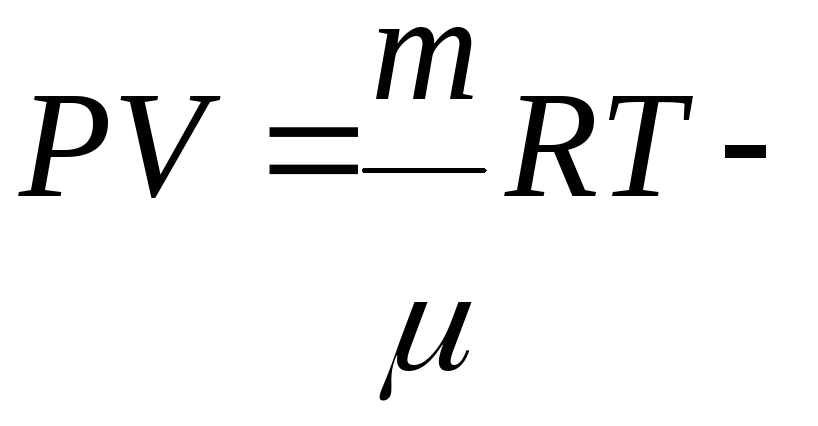 уравнение
Менделеева Клапейрона,
уравнение
Менделеева Клапейрона,
т.к. R = kNA , где k – постоянная Больцмана
k = 1.38 · 10-23 Дж/К из ** получаем
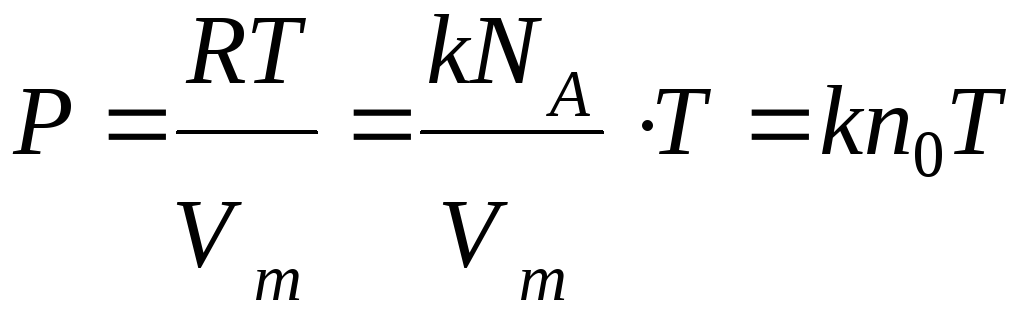
Р = kn0T
§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
При своём движении молекулы газа ударяются о стенку сосуда, создавая тем самым давление.
Если газ находится в равновесии все направления движения молекул равновероятны. Если n0 – концентрация молекул (число молекул в единице объёма)

то в данном направлении движется число молекул равное
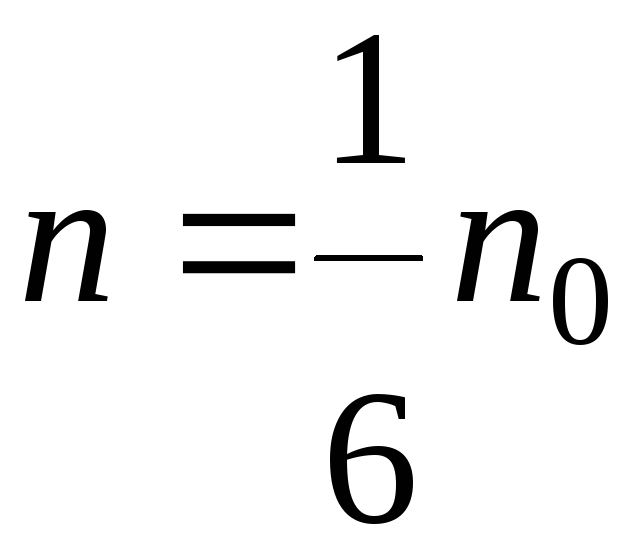 (в единице
объёма).
(в единице
объёма).

N = nVdt·S– число молекул, ударяющихся упруго о стенку за время dt. При этом
dP = 2m0V·N где m0 – масса одной молекулы и
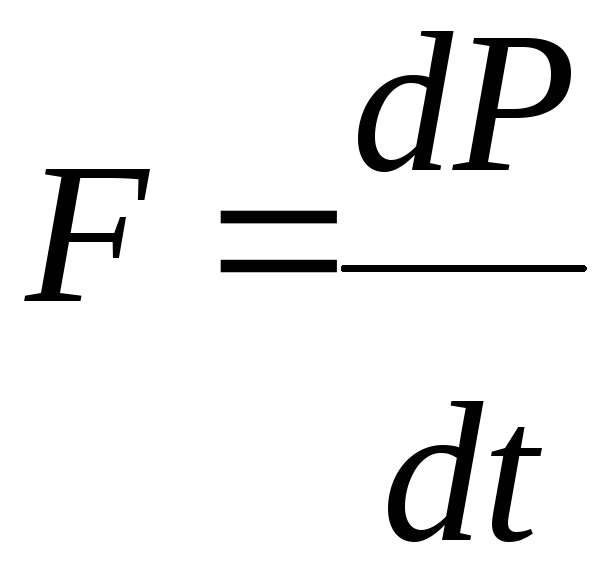 .
.
Следовательно
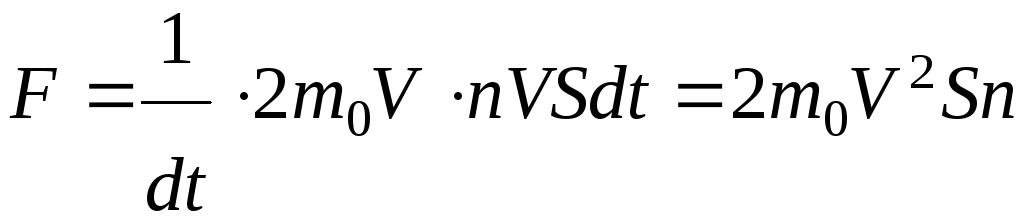
Откуда давление
![]()
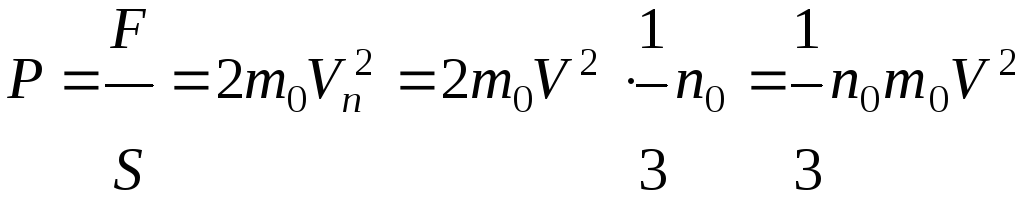
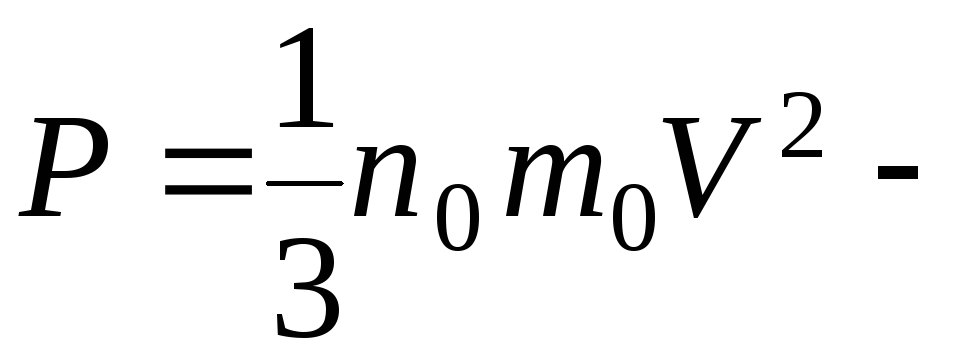 основное
уравнение молекулярно-кинетической
теории.
основное
уравнение молекулярно-кинетической
теории.
§2.5. Молекулярно-кинетический смысл температуры.
Сравнивая уравнения
P = n0 kT
и
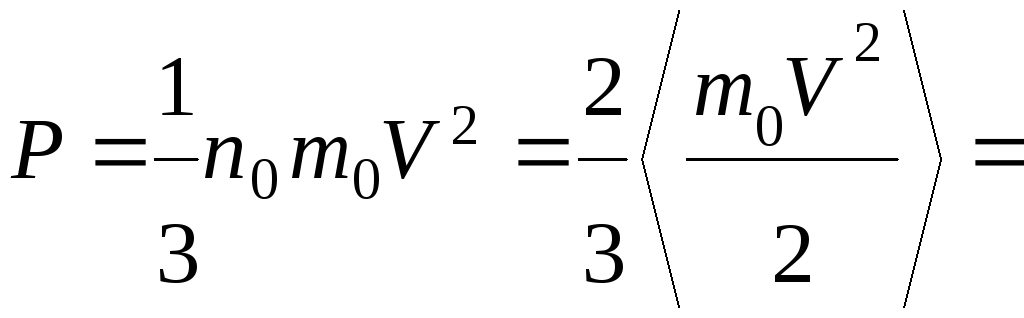
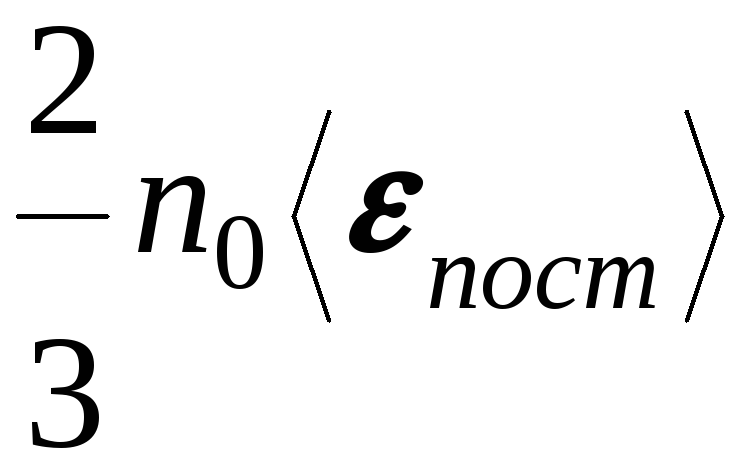 ,
,
где
![]() средняя кинетическая энергия
поступательного движения. Имеем
средняя кинетическая энергия
поступательного движения. Имеем

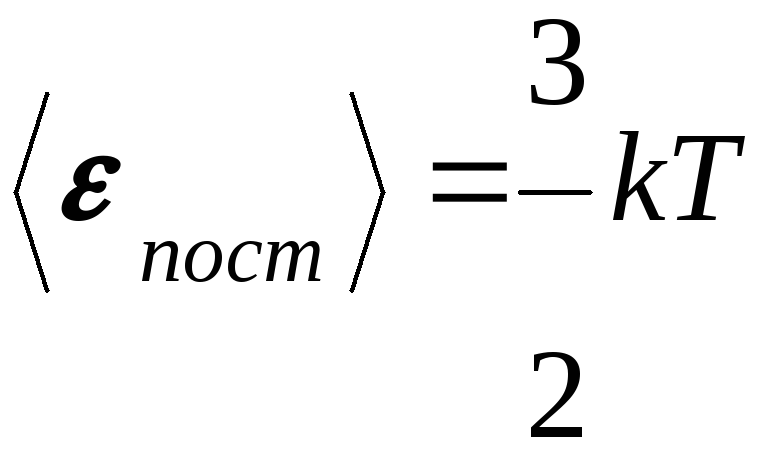
Термодинамическая температура есть мера кинетической энергии молекул.
Средняя энергия молекул зависит только от температуры и не зависит от массы молекул.

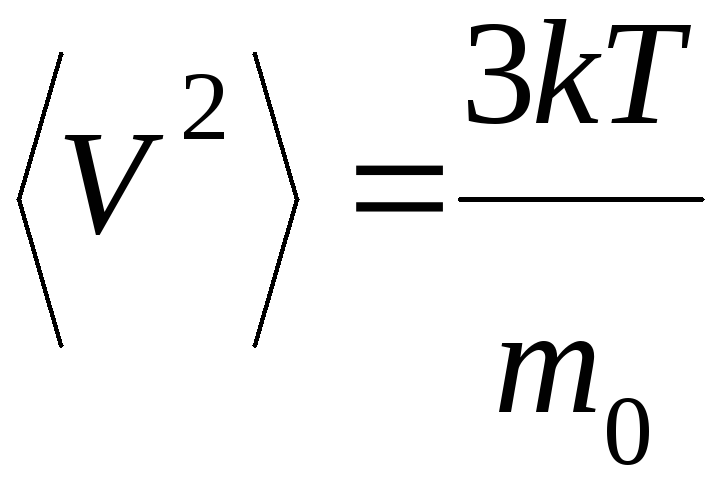
 среднеквадратичная
скорость молекул.
среднеквадратичная
скорость молекул.
Многоатомные молекулы кроме поступательного могут совершать также вращательное и колебательное движения. Эти виды движения связаны с запасом энергии, вычислить который позволяет устанавливаемый классической статистической физикой закон равнораспределения энергии по степеням свободы молекулы.
Числом степеней свободы механической системы называется количество независимых координат, с помощью которых может быть задано положение системы в пространстве.
Система из N материальных точек, между которыми нет жестких связей, имеет 3N, степеней свободы (положение каждой точки определяется тремя координатами x, y, z). Каждая жёсткая связь уменьшает число степеней свободы на единицу.
На каждую степень
свободы (поступательную, вращательную
и колебательную), в среднем, приходится
энергия, равная
![]() .
.
Поэтому средняя энергия молекулы
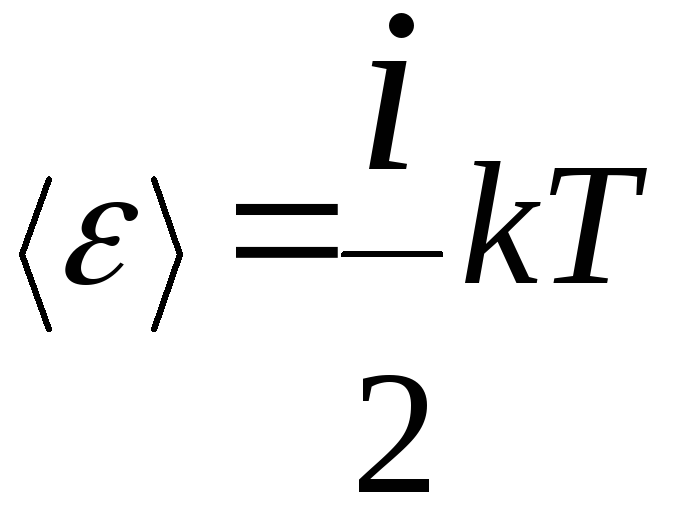
где i – сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы
i = iпост + iвращ + 2iколеб
(2iколеб, т.к. iколеб на потенциальную энергию и iпост на кинетическую энергию).
Закон равнораспределения получен на основе классических представлений о характере движения молекул. Поэтому он является приближенным и нарушается в тех случаях, когда становятся существенными квантовые эффекты.
Резюме
-
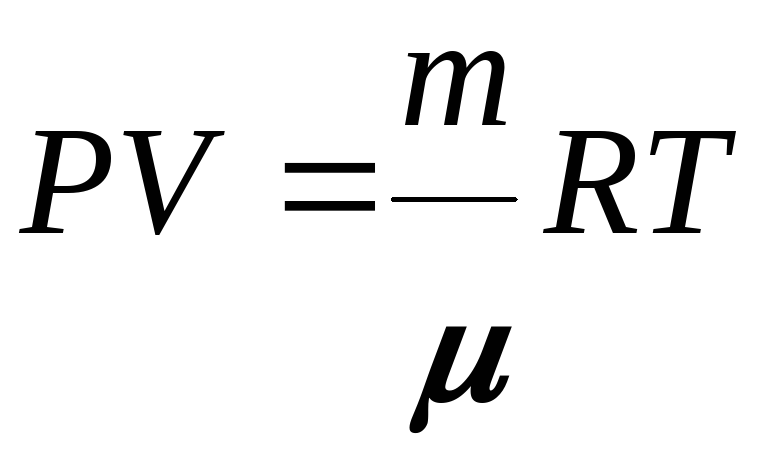
-
P = n0 kT
-

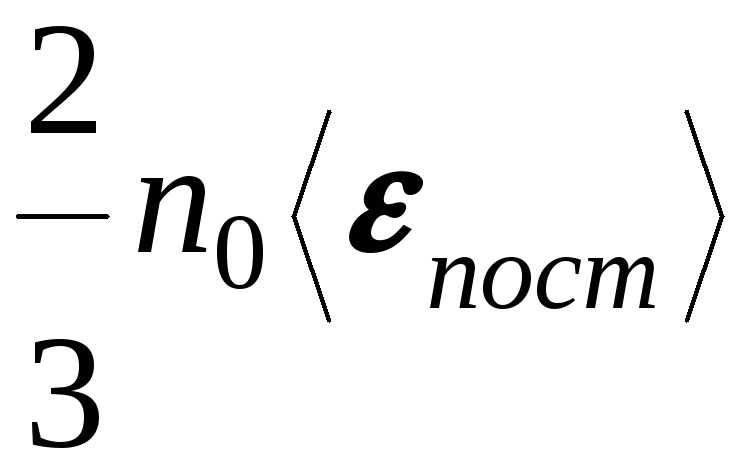 ,
, -
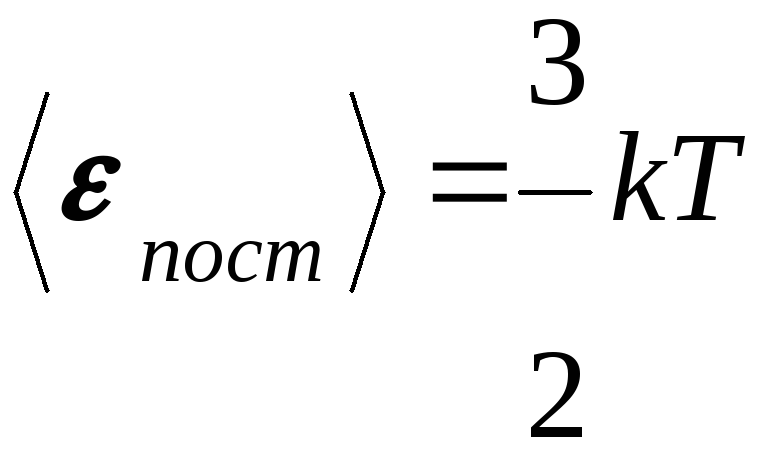
-
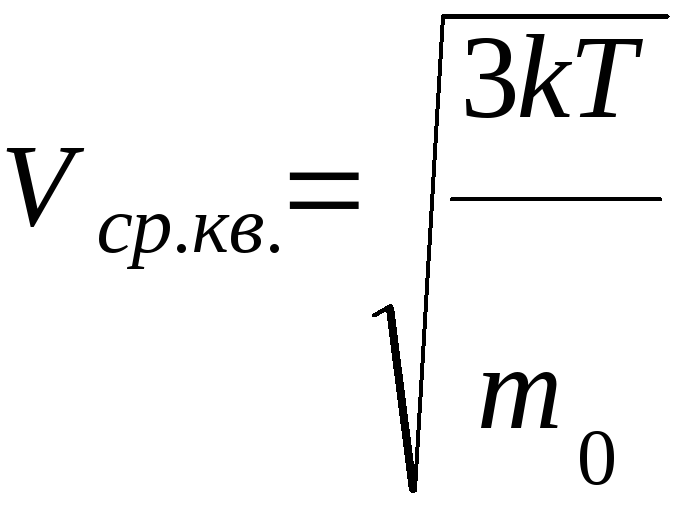
Л-11
