
- •Глава I. Физические основы динамики.
- •§1.1. Предмет механики. Кинематика и динамика. Классическая механика. Квантовая механика. Релятивистская механика.
- •§1.2. Силы.
- •§1.3. Элементы кинематики.
- •§1.4. Пространство и время.
- •§1.5. Кинематическое описание движения.
- •§1.6. Вектор перемещения. Скорость. Ускорение.
- •§1.7. Движение точки по окружности.
- •§1.8. Линейная скорость точки.
- •§1.9. Связь между угловыми и линейными параметрами движения.
- •Решение:
- •§1.10. Элементы динамики поступательного движения. Основная задача динамики. Понятие состояния в классической механике. Масса, импульс, сила.
- •§1.11. Современная трактовка законов Ньютона.
- •§1.12. Второй закон Ньютона как уравнение движения импульса.
- •§1.13. Третий закон Ньютона.
- •§1.14. Закон сохранения импульса.
- •§1.15. Реактивное движение. Уравнение Мещерского.
- •Решение
- •Решение
- •§1.16. Преобразование скорости и ускорения
- •§1.17. Неинерциальные системы отсчета. Силы инерции.
- •§1.18. Силы инерции.
- •§1.19. Особенности сил инерции.
- •§1.20. Принцип эквивалентности.
- •§1.21. Закон сохранения энергии.
- •§1.22. Связь между кинетическими энергиями в различных системах отсчета.
- •§1.23. Энергия движения тела как целого.
- •§1.24. Потенциальная энергия.
- •§1.25. Законы сохранения и симметрия пространства.
- •§1.26. Графическое представление энергии.
- •§1.27. Элементы механики твердого тела.
- •§1.28. Момент инерции диска. Теорема Штейнера
- •§1.29. Момент силы
- •§1.30. Работа при вращательном движении.
- •§1.31. Момент импульса. Закон сохранения момента импульса.
- •§1.32. Условия равновесия твердого тела.
- •§1.33. Принцип относительности в механике. Инерциальные системы отсчёта и принцип относительности. Преобразования Галилея.
- •§1.34. Постулаты специальной теории относительности.
- •§1.35. Следствия из преобразований Лоренца.
- •§1.36. Элементы релятивистской динамики.
- •§1.37. Работа и энергия. Законы сохранения энергии и импульса.
- •§1.38. Механика колебаний и волн.
- •§1.39. Векторные диаграммы.
- •§1.40. Комплексная форма представления колебаний
- •§1.41. Сложение гармонических колебаний.
- •§1.42. Биения
- •§1.43. Кинетическая и потенциальная энергия при гармонических механических колебаниях.
- •§1.44. Гармонический осциллятор.
- •§1.45.Свободные и затухающие колебания.
- •§1.46. Вынужденные колебания осциллятора под действием синусоидальной силы.
- •§1.47. Волновые процессы.
- •§1.48. Эффект Доплера.
- •§1.49. Групповая скорость и её связь
- •§1.50. Одномерное волновое уравнение.
- •Глава II. Статистическая физика и термодинамика.
- •§2.1. Динамические и статистические закономерности в физике. Статистический и термодинамический методы.
- •§2.2. Макроскопические состояния.
- •§2.3. Уравнение состояния идеального газа.
- •§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
- •§2.5. Молекулярно-кинетический смысл температуры.
- •§2.6. Статистические распределения.
- •§2.7.Скорости теплового движения частиц. Распределение частиц по абсолютным значениям скорости.
- •§2.8.Средняя кинетическая энергия частицы.
- •§2.9.Распределение Больцмана.
- •§2.10. Явления переноса. Понятие о физической кинетике.
- •§2.11. Эффективное сечение. Длина свободного пробега.
- •§2.12. Явления переноса.
- •§2.13. Теплопроводность.
- •§2.14. Диффузия.
- •§2.15. Внутреннее трение (вязкость).
- •§2.16. Основы термодинамики.
- •§2.17. Работа газа при изменении
- •§2.18. Эквивалентность теплоты и работы.
- •§2.19. Первое начало термодинамики.
- •§2.20. Теплоёмкость многоатомных газов.
- •§2.21. Применение первого начала термодинамики
- •§2.22. Работа в адиабатическом процессе.
- •§2.23. Энтропия.
- •§2.24. Изменение энтропии в изопроцессах.
- •4) Адиабатный.
- •§2.25. Связь энтропии с вероятностью состояния системы. Принцип возрастания энтропии.
- •§2.26. Свойства энтропии.
- •§2.27. Вычисление и применение энтропии.
- •§2.28. Цикл Карно.
- •§2.29. Второе начало термодинамики.
- •По Кельвину:
- •По Клаузиусу:
- •§2.30. Цикл Карно. Максимальный кпд тепловой машины.
- •§2.31. Фазовые равновесия и фазовые превращения. Фазы и фазовые превращения.
- •§2.32. Фазовые переходы I рода.
- •§2.33. Фазовые переходы II рода
- •§2.34. Условия равновесия фаз. Фазовые диаграммы.
- •§2.35. Метастабильные состояния.
- •§2.36. Реальные газы. Уравнение Ван-дер-Ваальса.
- •1) Учёт собственного объёма молекул.
- •2) Учёт притяжения молекул.
- •V метастабильные состояния Резюме
- •Оглавление
- •1.1. Элементы кинематики
- •1.2. Элементы динамики частиц
- •1.3. Законы сохранения импульса и механической энергии
- •1.4. Элементы механики твердого тела
- •1.5. Принцип относительности Галилея
- •1.6. Элементы релятивистской динамики
- •2. Механика колебаний и волн
- •2.1. Кинематика гармонических колебаний
- •2.2. Гармонический осциллятор
- •2.3. Волновые процессы
- •3. Статистическая физика и термодинамика
- •3.5. Реальные газы, жидкости и кристаллы
§2.16. Основы термодинамики.
Обратимые и необратимые тепловые процессы.
Термодинамический процесс обратим, если после него можно возвратить систему и все взаимодействующие с ней тела в начальные состояния так, чтобы в других телах не возникало каких-либо остаточных изменений. При обратимом процессе система может возвратиться в исходное состояние без изменений в окружающей среде.
Процесс, который не удовлетворяет этому условию, называется необратимым процессом.
Необходимое условие обратимости термодинамического процесса – его равновесность, т.е. всякий обратимый процесс всегда является равновесным (квазистатическим). Однако не всякий равновесный процесс обязательно обратим.
Пример обратимого процесса – незатухающие колебания, которые совершает в вакууме тело, подвешенное на абсолютно упругой пружине.
Пример необратимого процесса – торможение тела под действием силы трения.
§2.17. Работа газа при изменении
объёма.
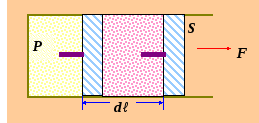
dA = F · dℓ F = P · S dℓ · S = dV
dA = P S · dℓ = Р · dV
dA = Р · dV


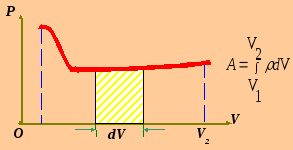
Графически можно изображать только равновесные процессы (параметры состояния имеют определённые значения). Они состоят из последовательности равновесных состояний и протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало.
Все реальные процессы неравновесны. Они протекают с конечной скоростью. Чем медленнее процесс, тем он ближе к равновесному.
§2.18. Эквивалентность теплоты и работы.
Обмен энергией между термодинамической системой и внешними телами можно осуществить двумя различными способами:
-
путем совершения работы и
-
путем теплообмена.
Работа совершается при силовом взаимодействии между телами.
Работу над системой производят внешние силы. Для совершения работы над макроскопической неподвижной системой нужно, чтобы перемещались взаимодействующие с ней тела, т.е. чтобы изменились внешние параметры состояния системы. В отсутствие внешних полей (силовых) обмен энергией между неподвижной системой и внешней средой может совершаться за счёт совершения работы лишь в процессе изменения объёма и формы системы. Работа А', совершаемая внешними телами над системой, численно равна и противоположна по знаку работе А, совершаемой самой системой над внешней средой, т.е. против внешних сил: A' = - A.
Теплообмен происходит между телами или частями одного тела, нагретыми до различной температуры.
В отличие от внутренней энергии системы, которая является однозначной функцией состояния системы, понятие теплоты и работы имеют смысл только в связи с процессом изменения состояния системы. Они являются энергетическими характеристиками этого процесса.
§2.19. Первое начало термодинамики.
В соответствии с законом сохранения энергии при любом способе перехода системы из одного состояния в другое изменение внутренней энергии ∆U = U2 – U1 будет одинаковым и равным разности между количеством теплоты Q, полученной системой, и работой А, совершенной системой против внешних сил.
∆U = Q – A
или Q = ∆U + A – первое начало Т.Д.
Теплота, сообщаемая системе, расходуется на изменение её внутренней энергии и на совершение ею работы против внешних сил. В дифференциальной форме
dQ = dU + dA
или более корректно
![]()
В этом выражении
dU
– полный дифференциал, а
![]() и
и
![]() таковыми
не является.
таковыми
не является.
