
- •Глава I. Физические основы динамики.
- •§1.1. Предмет механики. Кинематика и динамика. Классическая механика. Квантовая механика. Релятивистская механика.
- •§1.2. Силы.
- •§1.3. Элементы кинематики.
- •§1.4. Пространство и время.
- •§1.5. Кинематическое описание движения.
- •§1.6. Вектор перемещения. Скорость. Ускорение.
- •§1.7. Движение точки по окружности.
- •§1.8. Линейная скорость точки.
- •§1.9. Связь между угловыми и линейными параметрами движения.
- •Решение:
- •§1.10. Элементы динамики поступательного движения. Основная задача динамики. Понятие состояния в классической механике. Масса, импульс, сила.
- •§1.11. Современная трактовка законов Ньютона.
- •§1.12. Второй закон Ньютона как уравнение движения импульса.
- •§1.13. Третий закон Ньютона.
- •§1.14. Закон сохранения импульса.
- •§1.15. Реактивное движение. Уравнение Мещерского.
- •Решение
- •Решение
- •§1.16. Преобразование скорости и ускорения
- •§1.17. Неинерциальные системы отсчета. Силы инерции.
- •§1.18. Силы инерции.
- •§1.19. Особенности сил инерции.
- •§1.20. Принцип эквивалентности.
- •§1.21. Закон сохранения энергии.
- •§1.22. Связь между кинетическими энергиями в различных системах отсчета.
- •§1.23. Энергия движения тела как целого.
- •§1.24. Потенциальная энергия.
- •§1.25. Законы сохранения и симметрия пространства.
- •§1.26. Графическое представление энергии.
- •§1.27. Элементы механики твердого тела.
- •§1.28. Момент инерции диска. Теорема Штейнера
- •§1.29. Момент силы
- •§1.30. Работа при вращательном движении.
- •§1.31. Момент импульса. Закон сохранения момента импульса.
- •§1.32. Условия равновесия твердого тела.
- •§1.33. Принцип относительности в механике. Инерциальные системы отсчёта и принцип относительности. Преобразования Галилея.
- •§1.34. Постулаты специальной теории относительности.
- •§1.35. Следствия из преобразований Лоренца.
- •§1.36. Элементы релятивистской динамики.
- •§1.37. Работа и энергия. Законы сохранения энергии и импульса.
- •§1.38. Механика колебаний и волн.
- •§1.39. Векторные диаграммы.
- •§1.40. Комплексная форма представления колебаний
- •§1.41. Сложение гармонических колебаний.
- •§1.42. Биения
- •§1.43. Кинетическая и потенциальная энергия при гармонических механических колебаниях.
- •§1.44. Гармонический осциллятор.
- •§1.45.Свободные и затухающие колебания.
- •§1.46. Вынужденные колебания осциллятора под действием синусоидальной силы.
- •§1.47. Волновые процессы.
- •§1.48. Эффект Доплера.
- •§1.49. Групповая скорость и её связь
- •§1.50. Одномерное волновое уравнение.
- •Глава II. Статистическая физика и термодинамика.
- •§2.1. Динамические и статистические закономерности в физике. Статистический и термодинамический методы.
- •§2.2. Макроскопические состояния.
- •§2.3. Уравнение состояния идеального газа.
- •§2.4. Давление газа с точки зрения молекулярно-кинетической теории.
- •§2.5. Молекулярно-кинетический смысл температуры.
- •§2.6. Статистические распределения.
- •§2.7.Скорости теплового движения частиц. Распределение частиц по абсолютным значениям скорости.
- •§2.8.Средняя кинетическая энергия частицы.
- •§2.9.Распределение Больцмана.
- •§2.10. Явления переноса. Понятие о физической кинетике.
- •§2.11. Эффективное сечение. Длина свободного пробега.
- •§2.12. Явления переноса.
- •§2.13. Теплопроводность.
- •§2.14. Диффузия.
- •§2.15. Внутреннее трение (вязкость).
- •§2.16. Основы термодинамики.
- •§2.17. Работа газа при изменении
- •§2.18. Эквивалентность теплоты и работы.
- •§2.19. Первое начало термодинамики.
- •§2.20. Теплоёмкость многоатомных газов.
- •§2.21. Применение первого начала термодинамики
- •§2.22. Работа в адиабатическом процессе.
- •§2.23. Энтропия.
- •§2.24. Изменение энтропии в изопроцессах.
- •4) Адиабатный.
- •§2.25. Связь энтропии с вероятностью состояния системы. Принцип возрастания энтропии.
- •§2.26. Свойства энтропии.
- •§2.27. Вычисление и применение энтропии.
- •§2.28. Цикл Карно.
- •§2.29. Второе начало термодинамики.
- •По Кельвину:
- •По Клаузиусу:
- •§2.30. Цикл Карно. Максимальный кпд тепловой машины.
- •§2.31. Фазовые равновесия и фазовые превращения. Фазы и фазовые превращения.
- •§2.32. Фазовые переходы I рода.
- •§2.33. Фазовые переходы II рода
- •§2.34. Условия равновесия фаз. Фазовые диаграммы.
- •§2.35. Метастабильные состояния.
- •§2.36. Реальные газы. Уравнение Ван-дер-Ваальса.
- •1) Учёт собственного объёма молекул.
- •2) Учёт притяжения молекул.
- •V метастабильные состояния Резюме
- •Оглавление
- •1.1. Элементы кинематики
- •1.2. Элементы динамики частиц
- •1.3. Законы сохранения импульса и механической энергии
- •1.4. Элементы механики твердого тела
- •1.5. Принцип относительности Галилея
- •1.6. Элементы релятивистской динамики
- •2. Механика колебаний и волн
- •2.1. Кинематика гармонических колебаний
- •2.2. Гармонический осциллятор
- •2.3. Волновые процессы
- •3. Статистическая физика и термодинамика
- •3.5. Реальные газы, жидкости и кристаллы
§2.26. Свойства энтропии.
-
Энтропия – функция состояния. Если процесс проводят вдоль адиабаты, то энтропия системы не меняется. Значит адиабаты – это одновременно и изоэнтропы. Каждой более ,,высоко” расположенной адиабате отвечает большое значение энтропии.

-
Энтропия – величина аддиативная: энтропия макросистемы равна сумме энтропий ее отдельных частей.
-
Одно из важнейших свойств энтропии заключается в том, что энтропия замкнутой (т.е. теплоизолированной) макросистемы не уменьшается – она либо возрастает, либо остается постоянной.
Принцип возрастания энтропии замкнутых систем представляет собой еще одну формулировку второго начала термодинамики.
Величина возрастания энтропии в замкнутой макросистеме может служить мерой обратимости процессов, протекающих в системе.
Пример.
Идеальный газ,
находящийся в некотором состоянии,
адиабатически (т.е. без теплообмена)
расширили до объема
![]() Одинаково ли будет установившееся
давление газа в конечном состоянии (в
объеме
Одинаково ли будет установившееся
давление газа в конечном состоянии (в
объеме
![]() ),
если процесс расширения
),
если процесс расширения
![]() обратимый,
обратимый,
![]() необратимый
необратимый
В соответствии с принципом возрастания энтропии в замкнутой системе при необратимом процессе энтропия должна увеличиваться. Значит установившееся состояние будет соответствовать точке на более высокой адиабате, т.е. давление будет больше.
Теорема Нернста (1906). Это теорема утверждает, что при приближении температуры к абсолютному нулю энтропия макросистемы также стремится к нулю:
![]() при
при
![]()
и мы можем вычислять абсолютное значение энтропия по формуле

§2.27. Вычисление и применение энтропии.
-
Основное уравнение термодинамики. Оно представляет собой объединение энтропии с первым началом.
 .
Для обратимых процессов:
.
Для обратимых процессов:
![]()
Это уравнение имеет многочисленные применения.
-
Энтропия идеального газа. Пусть начальное и конечное состояния, 1 и 2, газа определяются параметрами
 и
и

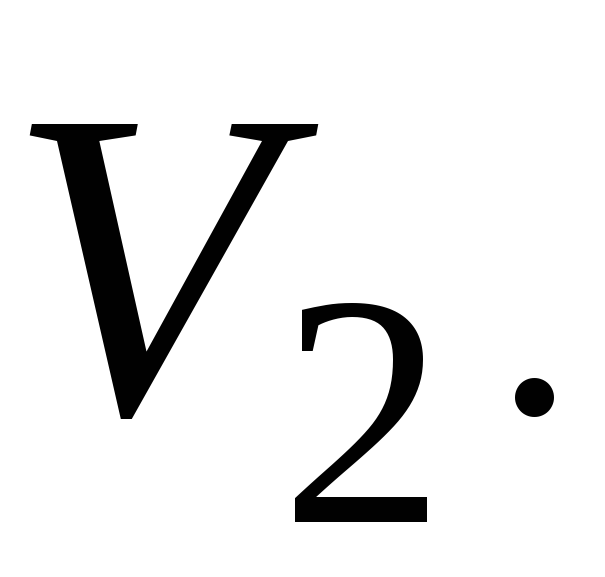
Элементарное
приращение энтропии газа с учетом, что
![]() и
и
![]() определяется
как
определяется
как

Взяв дифференциал
логарифма от
![]() получим
получим

формуле можно придать симметричный вид:

где учтено, что
![]()
Проинтегрировав последнее выражение получим в результате

-
Приращение энтропии при необратимом процессе между двумя равновесными состояниями 1 и 2. Приращение энтропии по обратимому изотермическому процессу:
 > 0.
> 0.
-
Возрастание энтропии при смешении газов. Пусть в двух половинах теплоизолированного сосуда объемом
 находятся
два идеального газа, 1 и 2, разделенных
перегородкой. Температура, давление и
число молей
находятся
два идеального газа, 1 и 2, разделенных
перегородкой. Температура, давление и
число молей
 и обеих половинах одинаково. После
удаления перегородки начинается
необратимый процесс смешения газов. В
конце концов он прекращается, и система
приходит в равновесное состояние, в
котором оба газа равномерно перемешаны.
Температура в конечном состоянии будет
такая же, так как система теплоизолирована
и газы идеальные. Используя результат
предыдущего примера, находим, что при
и обеих половинах одинаково. После
удаления перегородки начинается
необратимый процесс смешения газов. В
конце концов он прекращается, и система
приходит в равновесное состояние, в
котором оба газа равномерно перемешаны.
Температура в конечном состоянии будет
такая же, так как система теплоизолирована
и газы идеальные. Используя результат
предыдущего примера, находим, что при
 приращение
энтропии каждого газа
приращение
энтропии каждого газа
 т.е. суммарное приращение энтропии
системы
т.е. суммарное приращение энтропии
системы
![]()
Приращение ∆S
> 0, что естественно, поскольку процесс
смещения существенно необратимый
(обратимый процесс – самораспределение
смеси двух газов – совершенно невероятен).
Последняя формула приводит к выводу,
называемому парадоксом Гиббса. Формула
![]() справедлива только при смешивании
различных газов.
справедлива только при смешивании
различных газов.
