
- •Глава 13. Химия крови Кровь состоит из плазмы и форменных элементов.
- •Ведущая функция крови – транспортная
- •Белки – преобладающие компоненты плазмы
- •Патопротеинемия – любое отклонение от нормального соотношения белков в плазме крови
- •Уровень белков в плазме определяет распределение воды между кровью и тканями
- •Синтез белков плазмы – яркий пример механизма синтеза секретируемых белков.
- •Каждый белок плазмы характеризуется временем полураспада в кровообращении.
- •Содержание некоторых белков в плазме увеличивается во время острого воспаления.
- •Для классификации белков плазмы можно использовать разные подходы
- •Альбумин - главный белок плазмы человека
- •Глобулины - наиболее гетерогенная группа белков плазмы
- •Фракция α1-глобулинов
- •Недостаточность α1-антитрипсина ведет к эмфиземе легких
- •Фракция α2-глобулинов
- •Транспортный белок с ферментативной активностью – церулоплазмин
- •Фракция β-глобулинов
- •Иммуноглобулины – ведущие молекулы в механизмах защиты организма
- •Все иммуноглобулины состоят как минимум из двух легких и двух тяжелых цепей
- •Различают два типа легких цепей – λ и κ
- •Двух идентичных вариабельных областей не бывает
- •Функции, свойственные классу иммуноглобулина, определяют константные области молекул
- •Вместе с иммуноглобулинами на защиту организма может выступать система комплемента
- •Рис 13.5. Пути активирования системы комплемента Компоненты системы комплемента имеют специфические названия
- •Белки классического пути активирования комплемента
- •Лектиновый путь подобен классическому пути за исключением первой реакции
- •У альтернативного пути свой набор белков
- •В регуляции работы системы комплемента принимают участие специфические ингибиторы
- •Растворимые активные компоненты комплемента обладают широким спектром действия
- •Белки системы гемостаза
- •Сужение сосудов - первый этап гемостаза
- •Сосудисто-тромбоцитарный гемостаз – механизм остановки кровотечения при повреждении капилляров
- •Рис 13.6. Формы неактивных и активных тромбоцитов
- •Эндотелиоциты поддерживают кровь в жидком состоянии и участвуют в свертывании
- •Ингибиторы циклооксигеназной системы - эффективные антитромботические препараты
- •Классическая теория свертывание предложена п. Моравитцем и а Шмидтом.
- •Коагуляционный гемостаз состоит из трех фаз коагуляции и посткоагуляционной фазы
- •В зависимости от механизма первой фазы различают внутреннюю и внешнюю системы гемостаза
- •Фактор Ха – конечный продукт внутренней и внешней систем коагуляционного гемостаза
- •Вторая коагуляционная фаза – образованиие тромбина
- •Тромбин катализирует превращение фибриногена в фибрин в третью фазу коагуляции
- •Факторы свертывания крови происходят, по-видимому, из общего предшественника
- •Структурное подобие между белками дополняется общей зависимостью их функционального состояния от витамина к
- •Антитромботические механизмы предупреждают генерализацию свертывания крови в сосудах
- •Искусственные антикоагулянты могут быть прямого и непрямого действия
- •Гепарин, эдта и цитрат тормозят свертывание in vitro
- •Фибринолиз - важнейшая антисвертывающая система
- •Активаторы плазминогена выделены из тканей и биологических жидкостей
- •Ингибиторы фибринолиза - неотъемлемый компонент фибринолитической системы
- •Лабораторные тесты позволяют оценить состояние системы гемостаза у человека
- •Недостаточность факторов, тормозящих свертывание, обусловливает возникновение тромбозов
- •Кислотно-щелочное состояние
- •Концентрацию протонов необходимо поддерживать на постоянном уровне
- •Со2 – конечный продукт метаболизма и составляющая буферных систем организма
- •Цистеин и метионин важнейшие источники протонов
- •Буферные системы внеклеточного и внутриклеточного пространств.
- •Бикарбонатная буферная система является открытой системой
- •Гемоглобин является самым важным небикарбонатным буфером
- •Регуляция концентрации протонов
- •Легкие участвуют в регуляции бикарбонатной буферной системы
- •Синтез мочевины - один из путей регуляции кислотно-щелочного состояния
- •Почки участвуют в регуляции кщс путем выделения протонов
- •В моче также существует открытая буферная система
- •Ацидозы и алкалозы – это нарушения кислотно-щелочного состояния
- •РН-метры и газовые анализаторы позволяют поставить диагноз нарушения кщс
- •Самые частые нарушения кщс в медицинской практике – метаболические ацидозы
Фракция β-глобулинов
Главный белок, обеспечивающий транспорт железа, – трансферрин (сидерофилин), β1-гликопротеин плазмы крови, содержание в плазме – 1,6 – 2,8 г/л. Не связанную с железом форму называют апотрансферрином. Мол. масса – 76 – 77 кДа, изоэектрическая точка – 5,9. Содержание углеводов – 6,1 %. Полипептидная цепь содержит 680 аминокислотных остатков. Считают, что трансферрин состоит из двух одинаковых доменов, каждый из которых связывает по одному атому железа.
Апотрансферрин, связывая два атома железа, образует комплекс, окрашенный в розовый цвет с максимумом поглощения при длине волны 460 – 465 нм. Изменение поглощения при этой длине волны может быть использовано для определения связывания железа. Одновременно с присоединением железа молекула связывает два иона карбоната или бикарбоната, формируя сложный комплекс.
В молекуле трансферрина железо трехвалентное, однако более легко с ним связывается Fe2+, которое, окисляясь, превращается в трехвалентное. Различные анионы могут замещать бикарбонат: оксалат, малонат, пируват, лактат. Связывание каждого атома железа сопровождается выделением трех протонов из комплекса и присоединением одного бикарбонатного иона. На основании этих отличий удается выделить четыре формы трансферрина — апотрансферрин, две различные формы, содержащие по одному атому железа, и одну форму, имеющую два атома железа.
С трансферрином может связываться и большое число других металлов: Cu2+, Zn2+ Cr3+, Co3+, Mn3+, Cd3+. Уровень трансферрина увеличивается при беременности, железодефицитных анемиях, после введения эстрогенов, снижается при циррозах печени, белковом голодании, отравлении солями железа. Содержание трансферрина у здоровых составляет 2,42 г/л.
Гемопексин — β-гликопротеин с мол. массой 57 кДа, состоит из одной полипептидной цепи. Содержание углеводов до 20 %. Концентрация в плазме – 0,85 г/л.
Синтезируется в печени. Главная функция – связывание и транспорт гема, который рассматривается и как индуктор синтеза гемопексина. Каждая молекула гемопексина связывает одну молекулу гема. Такой комплекс легко захватывается из крови печенью.
Иммуноглобулины – ведущие молекулы в механизмах защиты организма
Основная часть γ -фракции белков плазмы крови представлена иммуноглобулинами. Они синтезируются плазмацитами, специализированными клетками, происходящими из В-лимфоцитов. В- и Т-лимфоциты – основные типы клеток иммунной системы. Если В-клетки ответственны за синтез циркулирующих, гуморальных антител, иммуноглобулинов, то Т-лимфоциты включаются в ряд важных опосредованных клетками иммунологических процессов, таких как отторжение трансплантата, реакции повышенной чувствительности и защита против злокачественных клеток и многих вирусов.
Все иммуноглобулины состоят как минимум из двух легких и двух тяжелых цепей
Все молекулы иммуноглобулинов состоят из двух идентичных легких (L) цепочек (мол. масса 23 кДа) и двух идентичных тяжелых (H) цепочек (мол. масса 53-75 кДа) связанных в форме тетрамера (L2H2) дисульфидными мостиками (рис 13.3 ).
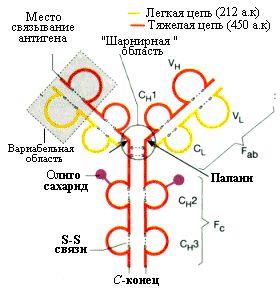
Рис.13.3. Структура иммуноглобулина G
В каждой цепочке можно выделить специфические домены, или области, характеризующиеся структурными и функциональными особенностями. Аминокислотная последовательность С-концевого отдела цепи легкой цепи (108–214-й аминокислотный остаток) постоянная (константная) –СL-область. N-концевой отдел легких цепей (1–107–й аминокислотный остаток) вариабельная (меняющаяся ) VL-область цепи. Одна четверть тяжелых (H) цепей (около 120 аминокислот) со стороны N -концевой аминокислоты названа переменной (вариабельной) областью (VH), а остальная часть тяжелой цепи (свыше 300 аминокислот) состоит из нескольких константных областей (CH1, CH2, CH3). N-концевые вариабельные участки легких (VL) и тяжелых(VH) цепей молекулы иммуноглобулина формируют домен молекулы, который связывает специфический антиген – активный центр антитела.
При кратковременном гидролизе иммуноглобулина папаином образуются два фрагмента, способных связывать антигены (Fab) и один фрагмент, способный формировать белковые кристаллы (Fc). Область в 15-65 аминокислотных остатков, в которой находится пептидные связи, гидролизуемые папаином, названа шарнирной областью.
