
- •Глава 13. Химия крови Кровь состоит из плазмы и форменных элементов.
- •Ведущая функция крови – транспортная
- •Белки – преобладающие компоненты плазмы
- •Патопротеинемия – любое отклонение от нормального соотношения белков в плазме крови
- •Уровень белков в плазме определяет распределение воды между кровью и тканями
- •Синтез белков плазмы – яркий пример механизма синтеза секретируемых белков.
- •Каждый белок плазмы характеризуется временем полураспада в кровообращении.
- •Содержание некоторых белков в плазме увеличивается во время острого воспаления.
- •Для классификации белков плазмы можно использовать разные подходы
- •Альбумин - главный белок плазмы человека
- •Глобулины - наиболее гетерогенная группа белков плазмы
- •Фракция α1-глобулинов
- •Недостаточность α1-антитрипсина ведет к эмфиземе легких
- •Фракция α2-глобулинов
- •Транспортный белок с ферментативной активностью – церулоплазмин
- •Фракция β-глобулинов
- •Иммуноглобулины – ведущие молекулы в механизмах защиты организма
- •Все иммуноглобулины состоят как минимум из двух легких и двух тяжелых цепей
- •Различают два типа легких цепей – λ и κ
- •Двух идентичных вариабельных областей не бывает
- •Функции, свойственные классу иммуноглобулина, определяют константные области молекул
- •Вместе с иммуноглобулинами на защиту организма может выступать система комплемента
- •Рис 13.5. Пути активирования системы комплемента Компоненты системы комплемента имеют специфические названия
- •Белки классического пути активирования комплемента
- •Лектиновый путь подобен классическому пути за исключением первой реакции
- •У альтернативного пути свой набор белков
- •В регуляции работы системы комплемента принимают участие специфические ингибиторы
- •Растворимые активные компоненты комплемента обладают широким спектром действия
- •Белки системы гемостаза
- •Сужение сосудов - первый этап гемостаза
- •Сосудисто-тромбоцитарный гемостаз – механизм остановки кровотечения при повреждении капилляров
- •Рис 13.6. Формы неактивных и активных тромбоцитов
- •Эндотелиоциты поддерживают кровь в жидком состоянии и участвуют в свертывании
- •Ингибиторы циклооксигеназной системы - эффективные антитромботические препараты
- •Классическая теория свертывание предложена п. Моравитцем и а Шмидтом.
- •Коагуляционный гемостаз состоит из трех фаз коагуляции и посткоагуляционной фазы
- •В зависимости от механизма первой фазы различают внутреннюю и внешнюю системы гемостаза
- •Фактор Ха – конечный продукт внутренней и внешней систем коагуляционного гемостаза
- •Вторая коагуляционная фаза – образованиие тромбина
- •Тромбин катализирует превращение фибриногена в фибрин в третью фазу коагуляции
- •Факторы свертывания крови происходят, по-видимому, из общего предшественника
- •Структурное подобие между белками дополняется общей зависимостью их функционального состояния от витамина к
- •Антитромботические механизмы предупреждают генерализацию свертывания крови в сосудах
- •Искусственные антикоагулянты могут быть прямого и непрямого действия
- •Гепарин, эдта и цитрат тормозят свертывание in vitro
- •Фибринолиз - важнейшая антисвертывающая система
- •Активаторы плазминогена выделены из тканей и биологических жидкостей
- •Ингибиторы фибринолиза - неотъемлемый компонент фибринолитической системы
- •Лабораторные тесты позволяют оценить состояние системы гемостаза у человека
- •Недостаточность факторов, тормозящих свертывание, обусловливает возникновение тромбозов
- •Кислотно-щелочное состояние
- •Концентрацию протонов необходимо поддерживать на постоянном уровне
- •Со2 – конечный продукт метаболизма и составляющая буферных систем организма
- •Цистеин и метионин важнейшие источники протонов
- •Буферные системы внеклеточного и внутриклеточного пространств.
- •Бикарбонатная буферная система является открытой системой
- •Гемоглобин является самым важным небикарбонатным буфером
- •Регуляция концентрации протонов
- •Легкие участвуют в регуляции бикарбонатной буферной системы
- •Синтез мочевины - один из путей регуляции кислотно-щелочного состояния
- •Почки участвуют в регуляции кщс путем выделения протонов
- •В моче также существует открытая буферная система
- •Ацидозы и алкалозы – это нарушения кислотно-щелочного состояния
- •РН-метры и газовые анализаторы позволяют поставить диагноз нарушения кщс
- •Самые частые нарушения кщс в медицинской практике – метаболические ацидозы
Искусственные антикоагулянты могут быть прямого и непрямого действия
При снижении антикоагулянтной активности крови в качестве лекарственных препаратов используют искусственные антикоагулянты прямого и непрямого действия.
Антикоагулянты прямого действия ингибируют процесс свертывания крови в результате инактивации факторов свертывания, находящихся в крови. В клинической практике среди антикоагулянтов прямого действия наибольшее распространение получил гепарин.
Он синтезируется и накапливается в гранулах тучных клеток (легкие, печень) и гранулоцитами крови. Фармакологический препарат гепарин – это смесь молекул гепарина разной молекулярной массы (5-30 кДа). Его введение оказывает сильный и быстрый антикоагулянтный эффект (снижение свертываемости крови начинается “на острие иглы"), но действует относительно кратковременно. Эффективность действия зависит от степени сульфатирования молекулы. На фоне дефицита АТ-III терапевтическая активность гепарина ослабевает. Эффект введенного гепарина (при передозировке препарата) можно снять введением протамина – белка с основными свойствами.
Антикоагулянты непрямого действия (фенилин, дикумарин, неодикумарин, ферромарон, синкумар и др.) широко используются для профилактики тромбообразования и тромбоэмболических осложнений. Антикоагулянтное действие этих препаратов основано на их антагонизме с витамином К (см. выше), что сопровождается выключением плазменных факторов VII, IX, X, II из процесса коагуляции крови. Антикоагулянты непрямого действия оказывают эффект не сразу, а спустя несколько часов и даже дней, и действуют продолжительно. Передозировку этих препаратов можно снять введением препаратов витамина К.
Гепарин, эдта и цитрат тормозят свертывание in vitro
Если необходимо получить кровь для исследований, то ее образец собирают в гепаринизированную пробирку. С той же целью можно использовать раствор ЭДТА или цитрата, которые связывают ионы кальция. Цитрат нашел широкое применение при заготовке крови для переливания.
Фибринолиз - важнейшая антисвертывающая система
Фибриновый сгусток, образовавшийся в процессе свертывания, постепенно растворяется в посткоагуляционную фазу свертывания. Фибринолиз – это расщепление фибрина (фибриногена) на растворимые низкомолекулярные пептиды с помощью фибринолитической системы, которая во многом по принципу организации подобна системе свертывания. Главным физиологическим ферментом, ответственным за фибринолиз, является сериновая протеаза – плазмин (фибринолизин), а реакции, обеспечивающие его активность, носят название плазминовой (фибринолитической) системы. Эта система включает плазмин и его профермент – плазминоген, активаторы плазминогена, проактиваторы плазминогена, ингибиторы плазмина и ингибиторы активаторов плазминогена.
Плазминоген – гликопротеин α-глобулиновой фракции белков плазмы крови. Одноцепочечная молекула с мол. массой 93 кДа.
Гетерогенность молекул может быть обусловлена их частичным гидролизом, различиями в составе углеводов и аминокислот. Препараты устойчивы в кислой среде, где выдерживают нагревание до 70°.
Место синтеза белка не установлено. Содержание в плазме колеблется в широких пределах: у мужчин – 195 мг/л, у женщин – до 250 мг/л. Время полураспада – 2,5 сут. За сутки разрушается и синтезируется около 5 мг плазминогена. Повышение содержания его наблюдается у больных со злокачественными опухолями, при туберкулезе, после облучения рентгеновскими лучами, снижение – при болезнях печени.
Под действием активаторов плазминоген быстро превращается в плазмин – сериновую протеиназу, расщепляющую лизил-аргининовые и лизил-лизиновые связи в белковых субстратах, главным образом, в фибрине и фибриногене (циркулирующий свободный плазмин способен также гидролизовать факторы V и VIII свертывающей системы крови, факторы комплемента, различные полипептидные гормоны)(рис.13.14). При активировании плазминогена в его молекуле гидролизуется пептидная связь арг Зб0 – вал361 , и молекула из одноцепочечной превращается в двухцепочечную молекулу плазмина (рис.13.13). N-концевая часть молекулы плазминогена образует тяжелую (А) цепь (мол. масса 60000 Да) плазмина, а легкая (В) цепь (мол. масса 25000 Да) образуется из С-концевого отдела плазминогена. В-цепь содержит обычный для сериновых протеиназ активный центр, имеющий остатки серина, гистидина и аспарагиновой кислоты.
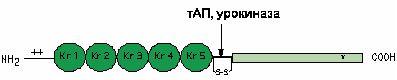
Рис.13.13.Схема строения плазминогена и место действия его активаторов
В А-цепи плазмина, также как и в молекуле плазминогена, имеется пять близких по аминокислотной последовательности петлеобразных участков кринглов (содержат по 80 аминокислотных остатков, скрепленных тремя дисульфидными связями), называемых лизинсвязывающими участками (ЛСУ). ЛСУ ответственны за взаимодействие плазминогена (плазмина) с фибрином (фибриногеном), а также с физиологическим ингибитором плазмина – α2-антиплазмином.

Рис.13.14.Схема фибринолиза
