
- •Глава 13. Химия крови Кровь состоит из плазмы и форменных элементов.
- •Ведущая функция крови – транспортная
- •Белки – преобладающие компоненты плазмы
- •Патопротеинемия – любое отклонение от нормального соотношения белков в плазме крови
- •Уровень белков в плазме определяет распределение воды между кровью и тканями
- •Синтез белков плазмы – яркий пример механизма синтеза секретируемых белков.
- •Каждый белок плазмы характеризуется временем полураспада в кровообращении.
- •Содержание некоторых белков в плазме увеличивается во время острого воспаления.
- •Для классификации белков плазмы можно использовать разные подходы
- •Альбумин - главный белок плазмы человека
- •Глобулины - наиболее гетерогенная группа белков плазмы
- •Фракция α1-глобулинов
- •Недостаточность α1-антитрипсина ведет к эмфиземе легких
- •Фракция α2-глобулинов
- •Транспортный белок с ферментативной активностью – церулоплазмин
- •Фракция β-глобулинов
- •Иммуноглобулины – ведущие молекулы в механизмах защиты организма
- •Все иммуноглобулины состоят как минимум из двух легких и двух тяжелых цепей
- •Различают два типа легких цепей – λ и κ
- •Двух идентичных вариабельных областей не бывает
- •Функции, свойственные классу иммуноглобулина, определяют константные области молекул
- •Вместе с иммуноглобулинами на защиту организма может выступать система комплемента
- •Рис 13.5. Пути активирования системы комплемента Компоненты системы комплемента имеют специфические названия
- •Белки классического пути активирования комплемента
- •Лектиновый путь подобен классическому пути за исключением первой реакции
- •У альтернативного пути свой набор белков
- •В регуляции работы системы комплемента принимают участие специфические ингибиторы
- •Растворимые активные компоненты комплемента обладают широким спектром действия
- •Белки системы гемостаза
- •Сужение сосудов - первый этап гемостаза
- •Сосудисто-тромбоцитарный гемостаз – механизм остановки кровотечения при повреждении капилляров
- •Рис 13.6. Формы неактивных и активных тромбоцитов
- •Эндотелиоциты поддерживают кровь в жидком состоянии и участвуют в свертывании
- •Ингибиторы циклооксигеназной системы - эффективные антитромботические препараты
- •Классическая теория свертывание предложена п. Моравитцем и а Шмидтом.
- •Коагуляционный гемостаз состоит из трех фаз коагуляции и посткоагуляционной фазы
- •В зависимости от механизма первой фазы различают внутреннюю и внешнюю системы гемостаза
- •Фактор Ха – конечный продукт внутренней и внешней систем коагуляционного гемостаза
- •Вторая коагуляционная фаза – образованиие тромбина
- •Тромбин катализирует превращение фибриногена в фибрин в третью фазу коагуляции
- •Факторы свертывания крови происходят, по-видимому, из общего предшественника
- •Структурное подобие между белками дополняется общей зависимостью их функционального состояния от витамина к
- •Антитромботические механизмы предупреждают генерализацию свертывания крови в сосудах
- •Искусственные антикоагулянты могут быть прямого и непрямого действия
- •Гепарин, эдта и цитрат тормозят свертывание in vitro
- •Фибринолиз - важнейшая антисвертывающая система
- •Активаторы плазминогена выделены из тканей и биологических жидкостей
- •Ингибиторы фибринолиза - неотъемлемый компонент фибринолитической системы
- •Лабораторные тесты позволяют оценить состояние системы гемостаза у человека
- •Недостаточность факторов, тормозящих свертывание, обусловливает возникновение тромбозов
- •Кислотно-щелочное состояние
- •Концентрацию протонов необходимо поддерживать на постоянном уровне
- •Со2 – конечный продукт метаболизма и составляющая буферных систем организма
- •Цистеин и метионин важнейшие источники протонов
- •Буферные системы внеклеточного и внутриклеточного пространств.
- •Бикарбонатная буферная система является открытой системой
- •Гемоглобин является самым важным небикарбонатным буфером
- •Регуляция концентрации протонов
- •Легкие участвуют в регуляции бикарбонатной буферной системы
- •Синтез мочевины - один из путей регуляции кислотно-щелочного состояния
- •Почки участвуют в регуляции кщс путем выделения протонов
- •В моче также существует открытая буферная система
- •Ацидозы и алкалозы – это нарушения кислотно-щелочного состояния
- •РН-метры и газовые анализаторы позволяют поставить диагноз нарушения кщс
- •Самые частые нарушения кщс в медицинской практике – метаболические ацидозы
Различают два типа легких цепей – λ и κ
Два типа легких цепей λ и κ различаются последовательностью аминокислот их СL-областей. Отдельная молекула иммуноглобулинов всегда содержит две легкие цепи одинакового типа и никогда не содержит их смеси. У людей цепи κ-типа встречаются чаще чем λ-типа.
NB! Пять типов тяжелых цепей определяют пять классов иммуноглобулинов
Исследования аминокислотного состава СН-областей тяжелых цепей у людей позволило выделить пять типов тяжелых цепей обозначенных γ, μ, α, δ и ε, имеющих мол. массу от 50 кДа до 70 кДа. Тип Н-цепей определяет класс иммуноглобулина и его функциональные особенности. Выделяют 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgЕ (рис.13.4). Структурные особенности СН-областей тяжелых цепей позволяют в каждом классе выделить отдельные подклассы иммуноглобулинов.
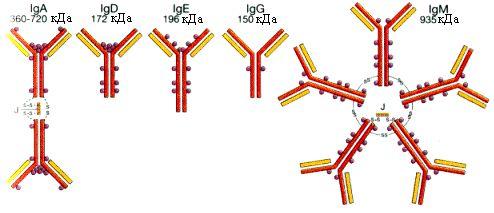
Рис.13.4. Схема строения основных иммуноглобулинов крови
Двух идентичных вариабельных областей не бывает
Вариабельные отделы иммуноглобулинов, состоящие из VL- и VH-доменов, характеризуются высокой гетерогенностью. Фактически, у различных людей не было обнаружено двух вариабельных областей с идентичной последовательностью аминокислот.
Функции, свойственные классу иммуноглобулина, определяют константные области молекул
Константные области молекул иммуноглобулинов, особенно CH2 и CН3 (и еще CН4 в IgM и IgD), входящие в фрагмент Fc, ответственны за функции различных молекул иммуноглобулинов, например, связывание комплемента или переход через плаценту.
Если одни иммуноглобулины (IgG) существует только в основной тетрамерной форме, то другие (IgA или gM) могут существовать в форме полимеров тетрамерных модулей:2,3 – для IgA или 5 – для IgM .
Иммуноглобулины G (IgG) – основные антитела плазмы крови и составляют 70 – 80 % всех иммуноглобулинов плазмы крови. Мол. масса IgG равна 150 кДа. Напротив, иммуноглобулины А — класс антител, преобладающих в секретах желез слизистых оболочек. Лишь 40 % всех IgA находятся в крови. Молекулы IgA , как правило, образуют полимерные формы. Мономерные формы имеют молекулярную массу 160 кДа. IgA активируют систему комплемента по альтернативному пути, связывают стафи лококковый белок А, участвуют в образовании ревматоидных факторов, соединяются с альбуминами, гликопротеинами, взаимодействуют только с нейтрофилами, не дают реакции пассивной кожной анафилаксии и не переносятся через плаценту и стенку кишечника.
Иммуноглобулины класса M (IgM) можно рассматривать как полимер пяти обычных молекул антител с мол. массой каждой субъединицы по 185 кДа, Н-цепи μ – типа. На молекулу пентамера приходится одна J-цепь. Общая мол. масса молекулы равна 900 кДа. Концентрация в плазме составляет 500 – 1500 мг/л. Синтезируются со скоростью 22 мг/кг/сут. Время полураспада – 5 дней. Обнаруживаются на ранних стадиях иммунного ответа на введение корпускулярных антигенов. Важнейшая эффекторная функция – активирование комплемента по классическому типу. С клетками практически не взаимодействуют.
Имуноглобулины D cодержатся в сыворотке крови в небольших концентрациях – 30 – 50 мг/л. Находятся, главным образом, в плазме крови. Молекула состоит из двух идентичных L-цепей (λ или κ) и двух Н-цепей с мол. массой 70 кДа. Синтезируется со скоростью 0,4 мг/кг/сут. Время полураспада – около 3 дней. Участвуют в активировании комплемента по альтернативному пути.
Иммуноглобулины Е. Входят в состав плазмы крови и секретов слизистых оболочек. Содержание в плазме – 10 мг/л. Состоят из двух легких цепей (22–23 кДа) и двух Н-цепей типа ε (71 кДа). Время полураспада – 2,4 сут. Скорость синтеза – 0,02 мг/кг/сут. Не проходят через плаценту и кишечник. Активируют комплемент по альтернативному пути. Могут присоединяться к лимфоцитам, гомологичным тучным клеткам и базофилам. Вызывают гиперсенсибилизацию анафилактического типа у различных животных.
И высокая и низкая продукция иммуноглобулинов могут приводить к заболеваниям
Клиническое значение имеет ряд врожденных и приобретенных нарушений обмена иммуноглобулинов, в частности, агамаиммуноглобулинемия.
Врожденная агаммаглобулинемия без лимфоцитопении – заболевание, характеризующееся врожденным значительным уменьшением содержания антител или отсутствием их. Нарушение связано с полом и наблюдается только у мальчиков. Встречается с частотой 1:100000 и проявляется между 6-м месяцем и 3-м годом жизни. В организме больных не образуются антитела на вводимые антигены. При этом резко повышается чувствительность и восприимчивость к бактериальным инфекциям. Рекомендуется заместительная терапия.
Вторичная приобретенная агамлаглобулинемия возникает при некоторых заболеваниях на фоне основной патологии.
При генерализованной неопластичеcкой пролиферации плазматических клеток (плазмоцитоме) повышается образование моноклональных иммуноглобулинов, что сопровождается тяжелым поражением паренхиматозных органов и разрушением костей. Накопление моноклональных иммуноглобулинов сопровождается иммунодефицитами. Плазмоцитому классифицируют по классам, подклассам и типам цепей иммуноглобулинов, которые синтезируются клетками. На фоне усиления образования иммуноглобулинов и их цепей преобладает синтез легких цепей, которые обнаруживаются в моче в виде белков Бенс-Джонса. Патологическое увеличение белков при плазмоцитоме связано с одним классом иммуноглобулинов: в 60 % случаев – с IgG, в 20 – с IgA, очень редко – с IgD и IgE. У больных плазмоцитомой плохо образуются антитела.
Описано и врожденное нарушение образования Н-цепей – болезнь тяжелых цепей, при которой Н-цепи накапливаются в организме и выделяются с мочой. В зависимости от типа Н-цепей различают болезнь у-γ типа, α-типа, μ-типа.
