
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
Все разнообразные методы, используемые при защите металлов от газовой коррозии, условно можно разделить на три группы: нанесение высокотемпературных защитных покрытий, легирование, применение защитных сред.
9.3. Электрохимическая коррозия
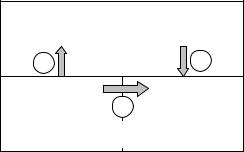
Электрохимическая коррозия металлов – коррозия, протекающая по электрохимическому механизму, – происходит в тех случаях, когда окружающая среда является электролитом. Обычно это водные растворы солей, кислот и щелочей, пленка воды с растворенными в ней газами, влага почвы и т.д. В этом случае коррозию можно представить как результат работы короткозамкнутого гальванического элемента (рис. 9.5).
электролит H2O + O2 + H+ + An-
Men+ |
|
Ox |
1 |
≈φкорр |
3 |
ē |
2 |
ē |
|
|
|
φа |
металл |
φк |
Рис. 9.5. Схема коррозионной электрохимической системы: 1 – окисление поверхностных атомов металла; 2 – переход электронов с анодного на катодный участок; 3 – восстановление ионов или молекул среды
Любые неоднородности поверхности металла или контактирующего с ним электролита (локальные различая концентрации растворенных веществ) приводят к образованию участков с различным значением электродных потенциалов. Вследствие электропроводности металла образуется система короткозамкнутых гальванических элементов. На участках с меньшим значением электродного потенциала (анод) происходит окисление поверхностных атомов металла:
анод (−): Ме0 → Меn+ + nē.
322
На участках с большим значением электродного потенциала (катод) происходит восстановление компонентов окружающей среды:
катод (+): Ox + nē → Red.
Отличительной особенностью коррозионного гальванического элемента является отсутствие внешней цепи. Электроны не выходят из корродирующего металла, а двигаются внутри него (см. рис. 9.5). При этом энергия электрохимической реакции переходит только в теплоту, которая рассеивается в окружающей среде.
Анодная и катодная реакции равновероятно могут протекать в любой точке однородной поверхности металла. В этом случае коррозия называется гомогенно-электрохимической. Обычно на границе раздела «металл–электролит» существуют неоднородности поверхности металла или электролита. Это приводит к возникновению участков, на которых энергетически выгодно протекание либо анодного, либо катодного процессов. В этом случае коррозия называется гетерогенно-электрохимической.
Неоднородность системы «металл–электролит» и, как следствие, возникновение коррозионных гальванических элементов могут быть вызваны следующими причинами:
•неоднородностью металла по химическому или фазовому составу (если, например, изделие состоит из деталей, изготовленных из разнородных металлов);
•наличием на поверхности окисных пленок;
•различием концентраций растворенных в электролите веществ на отдельных участках контакта металла с электролитом;
•неодинаковой температурой различных участков металла;
•механическими напряжениями в металлической детали. Обычно анодные и катодные участки поверхности металла
имеют малые размеры. При контакте металла с электролитом возникает большое число коррозионных микроэлементов, работа которых и приводит к электрохимической коррозии.
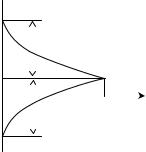
Короткозамкнутый гальванический элемент является полностью поляризованной электрохимической системой. В результате
поляризации (катода – ηк и анода – ηа) потенциалы анодных и ка-
тодных участков выравниваются и приобретают значение ϕкорр, ко-
торое называется стационарным потенциалом коррозии, которому
323
ϕ
ϕк |
|
|
|
соответствует |
максимальная |
плот- |
|
|
|
ηк |
|
|
ность коррозионного тока iкорр (рис. |
||
|
|
|
|
9.6). При этом коррозионная реакция |
|||
|
|
|
|
|
|||
ϕкорр |
|
|
|
протекает с |
максимальной |
скоро- |
|
|
|
|
стью. |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
iкорр |
i |
|
|
|
|
|
|
ηа |
|
|
9.3.1. Анодные и катодные реакции |
||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
а) 2H+ + 2ē → H2↑ pH < 7, б) О2 + 4H+ + 4ē → 2H2 pH < 7, 2H2O + 2ē → H2↑ + 2OH- pH ≥ 7 О2 + 2H2O + 4ē → 4OH− pH ≥7.
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например в условиях атмосферной коррозии.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Men+, OH- и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы. Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей. Например:
Ni2+ + 2OH- → Ni(OH)2↓;
Ni2+ + S2- → NiS↓;
324

2Cu2+ + СО2 + 4OH- → (CuOH)2СО3↓ + H2O;
4Fe(OH)2↓+ O2 + 2H2O → 4Fe(OH)3↓.
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поли-
кристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, т.е. состоит из нескольких фаз. При их контакте с электролитом образуется сово-
купность микрогальванических корро- |
|
|
|
|
|
зионных элементов. |
+ |
– |
pH<7 |
||
П р и м е |
р. Коррозия стального |
H2O + H + Cl |
|
||
|
|
|
|
||
Fe |
|
Fe3C |
|
||
изделия в растворе соляной кислоты. |
|
|
|||
|
|
||||
Сталь – гетерогенный сплав, содержа- |
|
|
|
|
|
щий в своем составе микрокристаллы |
|
|
|
|
|
железа (Fe) и |
карбида железа (Fe3C) |
Fe H+ Fe3C |
|||
(рис. 9.7). |
|
Рис. 9.7. Коррозия стали |
|||
Поскольку |
электродный потенциал |
||||
карбида железа больше, чем потенциал |
в кислоте |
|
|
|
|
железа, то в коррозионном гальваническом элементе Fe H+ Fe3C катодом будет карбид железа, а анодом – железо. Так как
ϕFe2+/Fe < ϕFe3+/Fe , железо будет окисляться до Fe2+, а на поверхности карбида железа будет протекать реакция с водородной деполяризацией катода:
анод (Fe): Fe0 → Fe2+ + 2ē;
катод (Fe3C): 2H+ + 2ē → H2↑.
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe0 + 2H+ → Fe2+ + H2↑.
Коррозия металла при неравномерной аэрации электролита.
При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
П р и м е р. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентра-
ция кислорода будет больше на краях (СО′′2 ) и меньше в центре
325
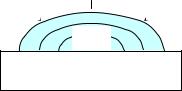
( СО′ 2 ). Поэтому под каплей центральная часть смоченной поверх-
ности металла будет анодом, а участок поверхности в виде кольца по краям капли – катодом (рис. 9.8).
О2 О2

 О2
О2
H2O
СО′2 < СО′′2
Cu
Cu(СО′2 ) H2O+O2 Cu( СО′′2 )
Рис. 9.8. Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном будет протекать реакция с кислородной деполяризацией:
анод (Cu(СО′2 )): Cu0 → Cu2+ + 2ē,
катод (Cu(СО′′2 )): О2 + 2H2O + 4ē → 4OH−.
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Cu2+ +2OH− → Cu(OH)2↓.
П р и м е ч а н и е. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
2Cu 2+ + СО2 + 4OH- →(CuOH)2СО3↓ + H2O.
Коррозия металла в напряженном состоянии. Под действи-
ем механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
П р и м е р. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии
(рис. 9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальваническо-
326

го элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al0 → Al3+ + 3ē,
катод (Alсжат): 2H2O + 2ē → H2↑ + 2OH−.
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:
Al3+ +3OH- → Al(OH)3↓.
H2O pH≈7
Al
Alрастянут H2O Alсжат
Рис. 9.9. Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
П р и м е р. Атмосферная коррозия оцинкованного железа при нарушении покрытия. Стандартные электродные потенциалы
металлов равны: ϕ0 |
2+ |
/Zn |
=−0,76 В; ϕ0 |
2+ |
/Fe |
=−0,44 В. Следова- |
Zn |
|
Fe |
|
|
тельно, в коррозионном гальваническом элементе Zn H2O+O2 Fe анодом будет цинк, а катодом – железо (рис. 9.10).
|
O2 |
H2O + O2 |
рН≈7 |
Zn |
|
Fe |
|
Zn H2O+O2 Fe |
|
Рис. 9.10. Коррозия оцинкованного железа при нарушении покрытия
При коррозии цинк окисляется, а на поверхности железа протекает реакция кислородной деполяризации катода:
327
