
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список

веществ, если в единичном акте анодных или катодных реакций участвует один электрон.
П р и м е ч а н и е. В общем случае число электронов, участвующих в единичном акте реакции (n), может различаться для катодного и анодного процессов. Если в результате протекания тока в электрохимической системе произведен перенос q = 1 F (Кл) количества электричества, то на электродах произой-
дет превращение ν = 1/n молей веществ, т.е. 1 моля эквивалентов.
Массы веществ, прореагировавших на электродах, можно рассчитать, умножив число молей на молярную массу М (г/моль) соответствующего вещества, а объем газов при нормальных условиях – умножив число молей на молярный объем V = 22,4 л/моль:
m= M |
|
It |
г, |
V = |
22,4 |
|
It |
л. |
|
F |
n |
F |
|||||||
n |
|
|
|
|
|
В реальных процессах часть электрической энергии расходуется не на основные процессы, а, например, на нагрев проводников или на протекание побочных химических реакций. Эффективность
электролиза учитывает коэффициент выхода по току η, равный отношению действительной массы вещества (m) к теоретически
рассчитанной (mр): η= m . Очевидно, что η < 1, т.е. количество mp
веществ будет получаться меньше расчетного: m= Mn FIt η г.
В самопроизвольном процессе при работе гальванического элемента для получения заданного количества электричества (q) веществ будет расходоваться больше, чем расчетное. Эффективность работы гальванического элемента характеризует коэффициент ис-
пользования вещества (λ). Если в реальном процессе при превра-
t
щении m г вещества получено q =∫I (t)dt количества электричест-
0
ва, то λ = q/qр, где qр – расчетное количество электричества. Впервые соотношения между количеством электричества, про-
шедшего через электрохимическую систему, и количеством веществ, участвовавших в реакциях, экспериментально были установлены в начале XIX в. Майклом Фарадеем, поэтому они часто называются законами Фарадея.
8.2. Электродные процессы
262
К электродным процессам относятся, в частности, химические реакции, протекающие на поверхности электрода, погруженного в электролит, приводящие к возникновению определенного значения электродного потенциала. Разность потенциалов между двумя электродами в электрохимической системе является причиной протекания в ней электрохимических процессов.
8.2.1. Скачок потенциала на границе «металл–электролит»
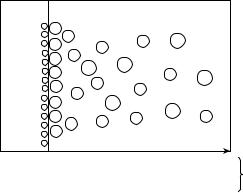
Рассмотрим систему, состоящую из металлического электрода, погруженного в раствор, содержащий катионы того же металла (раствор соли). Если металл находится в контакте, например, с водным раствором электролита небольшой концентрации, то на границе раздела фаз «металл–электролит» протекают следующие процессы (рис. 8.2).
1. В результате физико-химического взаимодействия между диполями воды и поверхностными ионами металла происходит его растворение. Особенности химической связи в металлах приводят к тому, что в раствор переходят только ионы металла, а электроны остаются в кристалле. В результате электрод приобретает избыточный отрицательный, а раствор – избыточный положительный заряды.
Металл |
|
Электролит H2O+ MeAn |
||||
Me0 - |
+ |
|
MeAn→Men++Ann- |
|||
- |
+ + |
|
+ |
|
- |
|
- |
+ |
|
||||
- |
+ + |
|
|
|
|
|
- |
- |
- |
|
|
||
- |
+ |
|
+ |
- |
||
- |
|
+ |
+ |
|||
- |
+ |
+ |
|
|
||
- |
+ |
|
- |
|
|
|
- |
|
|
- |
+ |
||
- |
+ |
+ |
+ |
+ |
||
- |
+ |
|
|
|
||
- |
|
|
Диффузия |
|
x |
|
- |
|
|
|
|
||
→Me0 + xH2O → Men+(H2O)x + nē
←Men+(H2O)x + nē → Me0+ xH2O Men+(H2O)x + nē ↔ Me0+ xH2O
Рис. 8.2. Схема возникновения обменного двойного электрического слоя на границе «металл–раствор электролита»
Самопроизвольное протекание этого процесса обусловлено как
263
энтальпийным, так и энтропийным факторами. Переход ионов металла из кристалла в раствор приводит к уменьшению энтальпии
системы (∆H<0), главным образом за счет экзотермической реак-
ции гидратации ионов металла, и увеличению энтропии (∆S > 0) вследствие разупорядочивания системы. Этот процесс можно записать как реакцию окисления металла:
Me0 + xH2O → Men+(H2O)x + nē.
2. Наличие катионов металла в растворе и отрицательный заряд электрода за счет избыточных электронов обусловливает протекание обратного процесса: катионы металла переходят из раствора на поверхность электрода. При этом они теряют свою гидратную оболочку и встраиваются в кристаллическую решетку, что приводит к уменьшению величин отрицательного заряда электрода и положительного заряда раствора. Этот процесс можно записать как реакцию восстановления металла:
Men+(H2O)x + nē → Me0+ xH2O.
В результате протекания этих процессов система придет в состояние равновесия. Скорости первого и второго процессов будут равны:
Men+(H2O)x + nē ↔ Me0+ xH2O.
При этом потенциал электрода и концентрация катионов в растворе сохранят постоянное равновесное значение.
Необходимо отметить, что концентрация катионов металла в растворе будет различной в зависимости от расстояния до поверхности электрода (рис. 8.3). Максимальным ее значение будет непосредственно у поверхности электрода (C0). За счет процесса диффузии ионы металла будут двигаться от поверхности электрода в объем раствора, при этом их концентрация уменьшится до величины C в глубине раствора. Таким образом, в состоянии равновесия установится постоянный градиент концентрации катионов.
П р и м е ч а н и е. С точки зрения термодинамики, в состоянии равновесия энергия (химический потенциал) поверхностных атомов металла равна энергии (химическому потенциалу) гидратированных ионов металла в растворе.
264
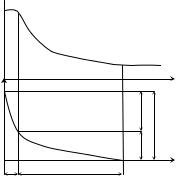
Рис. 8.3. Распределение концентрации ионов Меn+ (а) и потенциала (б) в ионной части двойного электрического слоя: а – изменение концентрации ионов Меn+ в электролите в зависимости от расстояния до электрода; C0 – концентрация в плотном слое; C – концентрация в объеме электролита; б – изменение электродного потенциала в зависимости от расстояния до электрода; ϕп – падение потенциала в плотном слое, ϕд – падение потенциала в диффузном слое; δп – толщина плотного слоя; δд – толщина диффузного слоя
а) C(x)
C0
|
|
C |
|
-φ(x) |
|
x |
|
|
|
||
б) |
ϕп |
|
|
|
ϕ |
||
|
|
||
|
ϕд |
x |
|
δп |
δд |
||
|
На границе «электрод–электролит» возникает обменный двойной электрический слой, образованный с одной стороны избыточными электронами в электроде, а с другой – избыточными положительными ионами металла в растворе (противоионами). Он рассматривается как единая электронейтральная система: заряд электрода равен сумме зарядов противоионов.
Поскольку существует разделение зарядов в пространстве, то между металлом и раствором возникает разность потенциалов (ϕ). Говорят, что при контакте металла с электролитом на границе раздела возникает скачок электрического потенциала – электродный потенциал.
Ионы металла, образующие двойной электрический слой, распределены в растворе следующим образом (см. рис. 8.3).
Часть ионов располагается на расстоянии порядка радиуса гидратированного иона от поверхности металла, образуя плотный
слой, толщина которого составляет величину δп ~ 10–10 м. Концен-
трация ионов металла в нем равна C0, падение потенциала (ϕп) происходит линейно.
Другая часть ионов за счет диффузии перемещается в глубь раствора, образуя диффузный слой. Концентрация ионов уменьшается от C0 до величины концентрации ионов металла в электролите C. Толщина диффузного слоя зависит от концентрации ионов ме-
талла в электролите и составляет величину порядка δд ~ |
~10– |
9…10–5 м. Падение потенциала в диффузном слое (ϕд) происходит |
|
нелинейно. С увеличением концентрации катионов в |
электро- |
265
