
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список

2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
Наиболее наглядно вероятность нахождения электрона в про-
странстве |
характеризует |
функция распределения электронной |
|||
|
|
|
плотности (вероятность нахождения элек- |
||
+ |
r |
r+dr |
трона в элементарном объеме пространст- |
||
ва). Для атома водорода таким элементар- |
|||||
|
|||||
|
|
|
ным |
объемом пространства является |
|
Рис. 2.8. Элементарный |
сферический слой толщиной dr (рис. 2.8), а |
||||
зависимость вероятности нахождения элек- |
|||||
сферический слой: |
трона в нем от расстояния до ядра – функ- |
||||
dV = 4πr2dr − объем |
|||||
сферического слоя |
ция радиального распределения электрон- |
||||
|
|
|
ной плотности. |
||
Вероятность нахождения электрона в элементарном сферическом слое
dP = Ψ2 dV = Ψ2 4πr2dr.
Радиальное распределение электронной плотности – зависи-
мость плотности вероятности dPdr от радиуса – равно:
σ(r) = dPdr = Ψ2 4πr2 =[ |
|
1 |
|
e−a r ]2 4πr2 . |
|
|
|
||
πa−3 |
Вероятность нахождения электрона в сфере радиусом r
r
P(r)=∫Ψ2 4πr2dr .
0
Какие выводы можно сделать из функции радиального распределения электронной плотности для основного состояния атома водорода (рис.2.9)?
σ(r) |
σ(r)-max |
|
P(r) 1.0 |
|
|
P=0.33 P=0.90 |
|
|
0.9 |
|
1.41Å |
|
|
|
|
|
0.5 |
|
|
|
0.53Å |
|
|
|
|
|
|
|
|
|
|
|
|
1.41Å |
0 |
1.0 |
2.0 |
0 |
1.0 r, Å 2.0 |
|
r, Å |
|||
Рис. 2.9. Радиальное распределение электронной плотности − σ(r). Вероятность нахождения электрона в сфере радиусом r − [Р(r)]
45
1. Функция σ(r) имеет максимум при r = 1/a = 0,53 Å.На этом расстоянии от ядра максимальна вероятность нахождения электрона. Необходимо отметить, что это расстояние совпадает с радиусом первой орбиты по теории Бора. Оно находится из условия равенства нулю первой производной функции радиального распределения:
dσ |
= |
d |
(A2e−2a r 4πr2 )=A2 (e−2ar 8πr −2ae−2ar 4πr2 ) , |
|
dr |
dr |
|||
|
|
|||
|
|
|
A2e−2ar 8πr (1−ar)=0 , r =1/a . |
2. Функция радиального распределения – вероятность нахождения электрона в элементарном объеме пространства – асимптотически стремится к нулю при увеличении расстояния от ядра (при
r → ∞ σ(r) → 0), но не становится равной нулю. При этом вероятность нахождения электрона в сфере Р(r) с увеличением радиуса сферы асимптотически приближается к единице, но не становится равной единице ни на каком расстоянии. Поэтому точно указать объем пространства, в котором вероятность нахождения электрона равна единице, невозможно, как невозможно указать, в какой точке пространства находится электрон в данный момент. Поэтому указывается объем пространства, в пределах которого вероятность нахождения электрона составляет величину 0,9 (90%). Данная об-
ласть пространства называется орбиталью электрона, в отличие от орбиты в классической теории. Для основного состояния атома водорода радиус орбитали составляет величину r = 1,41Å.
2.3.3. Возбужденные состояния атома водорода
Полученное решение уравнения Шрёдингера для основного состояния атома водорода является частным случаем, когда волновая функция сферически симметрична и не зависит от угловых координат. Для атома водорода решениями уравнения Шрёдингера могут быть и другие функции более сложной симметрии.
В общем виде волновая функция в полярных координатах является функцией трех переменных: Ψ=Ψ(r,ϑ,ϕ) , поэтому уравнение
Шрёдингера будет представлять собою дифференциальное уравнение с частными производными. Стандартный метод решения уравнения данного типа − метод разделения переменных.
Полагают, что волновая функция Ψ(r, ϑ, ϕ) может быть пред-
46

ставлена в виде произведения трех волновых функций, каждая из которых содержит только одну переменную:
Ψ(r, ϑ , ϕ) = R(r)Θ(ϑ)Φ(ϕ),
где R(r) – функция радиального; Θ(ϑ) и Φ(ϕ) – функции углового распределения электронной плотности.
Часто две угловые функции заменяют одной функцией углового распределения Y(ϑ , ϕ):
Ψ(r, ϑ ,ϕ) = R(r)Y(ϑ ,ϕ).
Явный вид волновых функций, являющихся решениями уравнения Шрёдингера, содержит целочисленные параметры: R(r) – n, l, а Y(ϑ, ϕ) – l, m.
Таким образом, решением общего волнового уравнения является набор волновых функций, которые содержат в качестве целочисленных параметров три числа: n, l, m, получивших названия главного (n), орбитального (l) и магнитного (m) квантовых чисел. Квантовые числа характеризуют энергетические состояния электрона в атоме водорода.
Физический смысл квантовых чисел. n − главное квантовое число – определяет разрешенные (дискретные, квантовые) значения полной энергии электрона, характеризует размер электронных орбиталей (соответственно является мерой расстояния между электроном и ядром).
Решение уравнения Шрёдингера дает следующее выражение для возможных значений полной энергии электрона в атоме водорода:
En =−2π2mk2e4 1 . h2 n2
Главное квантовое число может принимать целочисленные зна-
чения от единицы до бесконечности: n = 1,2,3,4…∞.
l – орбитальное квантовое число – определяет возможные квантовые значения орбитального момента количества движения электрона, т.е. связано с его кинетической энергией. Пространственная конфигурация (форма) электронной орбитали связана со значением орбитального квантового числа. Возможные величины l соответствуют n и могут принимать целочисленные значения от нуля до n–1: l = 0,1,2,3...(n – 1).
Исторически сложилось, что численным значениям l соответст-
47
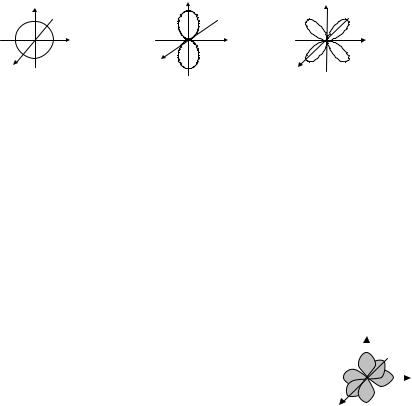
вуют буквенные обозначения: l = 0 – s; l = 1 – p; l = 2 – d; l = 3 – f и т.д. Они соответствуют также электронам, их волновым функциям, орбиталям и энергетическим состояниям.
Пространственная конфигурация простейших орбиталей (форма) показана на рис. 2.10: s-орбиталь (l = 0) сферически симметричная; p-орбиталь (l = 1), d-орбиталь (l = 2), f-орбиталь (l = 3) и т.д имеют более сложную пространственную симметрию.
l = 0 |
l = 1 |
l = 2 |
s-орбиталь |
p-орбиталь |
d-орбиталь |
Рис. 2.10. Пространственная конфигурация простейших орбиталей
m – магнитное квантовое число – определяет разрешенные на-
правления в пространстве вектора орбитального момента количества движения. Возможные величины m определяются для каждого значения l и могут принимать целочисленные значения от от +l до
−l: m = +l, (l−1),...,0,...,(−l+1), −l.
Набор значений m определяет число возможных ориентаций s, p, d, … орбиталей в пространстве для данного числа n:
s-орбитали (l=0) – магнитное квантовое число принимает единственное значение: m = 0 – единственный способ ориентации в пространстве (сферически-симметричная орбиталь).
p-орбитали (l = 0) – магнитное квантовое число принимает три
возможных значения: m = +1, 0, −1 – три возмож- |
|
z |
||
ных способа ориентации орбитали в пространст- |
|
|||
ве (рис. 2.11). |
|
pz |
|
|
d-орбитали (l = 2) – магнитное квантовое чис- |
|
|
|
y |
ло принимает пять возможных значений: m = +2, |
|
xpx |
py |
|
+1, 0, −1, −2 – пять возможных способов ориен- |
|
|
||
тации орбитали в пространстве (рис. 2.12). |
|
Рис. 2.11. Воз- |
||
Поскольку потенциальная энергия частицы за- |
|
|||
можные ориента- |
||||
висит от ее положения в пространстве, то маг- |
|
ции p-орбитали |
||
нитное квантовое число связано с потенциальной |
|
в пространстве |
||
энергией электрона.
Электронные орбитали атома водорода. Поскольку элек-
тронную орбиталь характеризует набор трех квантовых чисел, то
48
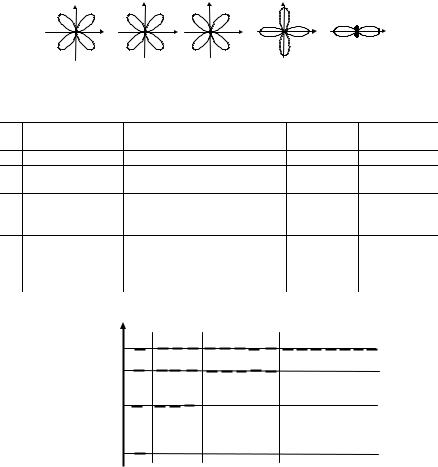
путем их комбинаций получают все возможные электронные орбитали атома водорода. Для первых четырех значений главного квантового числа возможные орбитали (энергетические состояния электрона) приведены в табл. 2.1 и на энергетической диаграмме
(рис. 2.13).
|
|
y dxy |
z |
dyx |
z |
dyz |
y |
dx2-y2 |
dz2 |
|
|
x |
|
x |
|
y |
|
x |
z |
|
|
Рис. 2.12. Возможные ориентации d-орбитали в пространстве |
|||||||
n |
|
|
|
|
|
|
|
|
Т а б л и ц а 2.1 |
l=0,1,2…(n−1) |
m=+l, (l–1),...0...(– l+1),−l |
|
Энергия |
Число орби- |
|||||
|
|
|
|
|
|
|
|
орбитали |
талей |
1 |
0 |
– s |
0 |
|
|
|
|
E1 |
1 |
2 |
0 |
– s |
0 |
|
|
|
|
E2 |
1 |
|
1 |
– p |
+1,0,-1 |
|
|
|
|
3 |
|
3 |
0 |
– s |
0 |
|
|
|
|
E3 |
1 |
|
1 |
– p |
+1,0,-1 |
|
|
|
|
3 |
|
|
2 |
– d |
+2,+1,0,-1,-2 |
|
|
|
|
5 |
|
4 |
0 |
– s |
0 |
|
|
|
|
E4 |
1 |
|
1 |
– p |
+1,0,-1 |
|
|
|
|
3 |
|
|
2 |
– d |
+2,+1,0,-1,-2 |
|
|
|
|
5 |
|
|
3 |
– f |
+3,+2,+1,0,-1,-2,-3 |
|
|
7 |
|||
|
|
E |
|
|
|
|
|
|
|
|
|
n=4 E4 |
4s |
4p |
|
4d |
|
4f |
|
|
|
n=3 E3 |
|
|
|
||||
|
|
3s |
3p |
|
3d |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
n=2 E2 |
2s |
2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
n=1 E1 |
1s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 2.13. Диаграмма энергетических состояний электрона в атоме водорода
Обозначение орбитали складывается из цифры, указывающей главное квантовое число, и буквы, указывающей тип орбитали
49
(орбитальное квантовое число). Например, 5р – это орбиталь, имеющая n = 5 и l = 1. Графически орбитали изображают в виде черточек или прямоугольников.
На приведенной диаграмме видно, что для атома водорода энергетические состояния электрона вырождены по орбитальному и магнитному квантовым числам (энергия электрона зависит только от главного квантового числа):
E1s < E2s = E2p< E3s = E3p = E3d < E4s = E4p = E4d = E4f < …
Спиновое квантовое число. Кроме трех квантовых чисел имеется четвертое – спиновое (ms), которое не входит в решения уравнения Шрёдингера для атома водорода.
Вмодели Джорджа Уленбека и Самуэла Гаудсмита спиновое квантовое число характеризует собственный момент количества движения и может принимать только два значения: ±½, которые соответствуют вращению электрона вокруг собственной оси по или против часовой стрелки. Это вращение создает собственный магнитный момент электрона, взаимодействие которого с магнитным полем атома приводит к двум возможным энергетическим состояниям.
В1933 г. Поль Дирак описал состояние электрона в атоме с учетом релятивистских эффектов (привел в соответствие представления Шрёдингера с теорией относительности Эйнштейна). Полученные решения содержат, кроме трех квантовых чисел, чет-
вертый параметр – спиновое квантовое число (mS).
Радиальное распределение электронной плотности. В кван-
тово-механической модели атома не существует понятия траектории движения электрона, оно заменено на вероятность нахождения электрона в элементарном объеме пространства, а каким образом туда попадает электрон, не определяется. Так же как и для основного состояния, для возбужденных состояний имеются функции радиального распределения электронной плотности:
σ(r) = dPdr = ψ2 4πr2.
Графический вид функций приведен на рис. 2.14. Площадь под любой кривой радиального распределения равна единице, поскольку она равна вероятности нахождения электрона во всем объеме:
∞∞
∫σ(r)dr =∫Ψ2 4πr2dr =1.
0 0
50
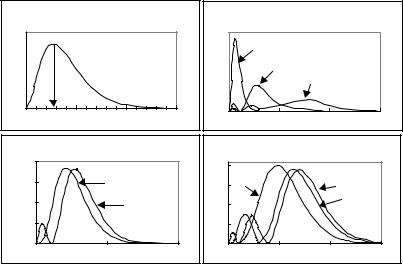
Относительные единицы
0
Относительные единицы
Радиальное распределение |
|
|
|
Радиальное распределение |
|
||
электронной плотности 1s |
|
|
|
|
|||
|
|
|
электронной плотности 1s , 2s , 3s |
|
|||
|
|
|
|
|
|
||
|
|
|
|
Относительные единицы |
1s |
|
|
|
|
|
|
2s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
r =0.53 A |
|
r, |
A |
|
|
|
|
|
|
|
|
|
r , A |
||
1 |
2 |
3 |
|
0 |
5 |
10 |
15 |
Радиальное распределение |
|
|
|
Радиальное распределение |
|
||
электронной плотности 2s , 2p |
|
|
|
электронной плотности 3s , 3p , 3d |
|
||
|
2p |
|
|
Относительные единицы |
3d |
3s |
|
|
|
|
|
|
|
||
|
2s |
|
|
|
|
3p |
|
|
|
|
|
|
|
|
|
|
|
r , A |
|
|
|
r , A |
|
0 |
5 |
10 |
|
0 |
5 |
10 |
15 |
Рис. 2.14. Функции радиального распределения электронной плотности для различных энергетических состояний атома водорода
В радиальном распределении 1s-электрона имеется один максимум на расстоянии, равном первому боровскому радиусу (1/a = =0,53Å). Число максимумов в функции распределения ns электронов (n > 1) равно n, 2s – два максимума, 3s – три максимума и т.д.
Функции радиального распределения для p-, d-, f-электронов подобны функциям для s-электронов, с учетом того, что число максимумов равно n – l: 1s, 2p, 3d...– функции радиального распределения с одним максимумом, 2s, 3p, 4d... – с двумя, 3s, 4p, 5d..
– с тремя максимумами.
Из приведенных рисунков видно, что, во-первых, положение главного максимума − расстояние от ядра до области с максимальной вероятностью нахождения электрона − определяется в основном главным квантовым числом n, т.е. можно говорить о том, что n характеризует «расстояние электрона до ядра». Во-вторых, для электронов, находящихся в состояниях с одинаковым главным квантовым числом, вероятность нахождения электрона вблизи ядра уменьшается с увеличением орбитального квантового числа (иногда говорят о различной «проникающей способности» орбиталей). Это имеет большое значение при рассмотрении многоэлектронных атомов.
51
