
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
извольного протекания процессов. Термодинамика изучает энергетические переходы макроскопических систем в целом, не вдаваясь
вподробности, связанные с микроскопическим строением системы и «судьбой» отдельных составляющих ее частиц. В отличие от теории строения вещества и химической связи термодинамическому изучению подвергаются системы, состоящие только из большого (статистически значимого) числа частиц. Раздел термодинамики, в котором рассматриваются изменения энергии систем
входе химических превращений, называется химической термо-
динамикой – термодинамикой химических процессов.
5.1.Основные понятия и определения
5.1.1.Термодинамическая система
Термодинамическая система – совокупность взаимодействующих между собой физических тел, выделенная из окружающего пространства реальной или мысленной границей. Остальная часть пространства является внешней (окружающей) средой (рис.5.1). Взаимодействие термодинамической системы с окружающей средой осуществляется путем обмена веществом и энергией.
|
|
δQ>0 |
δW>0 |
||||||||
|
|
|
|
|
|
||||||
Окружающая |
Термодинамическая |
Окружающая |
|||||||||
среда |
|
система |
|
|
среда |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δQ<0 |
|
δm |
|
|
δW<0 |
||||
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 5.1. Обмен энергией и веществом между термодинамической системой
иокружающей средой
Взависимости от свойств границ между термодинамической системой и окружающей средой выделяют системы:
•изолированные – отсутствует обмен веществом и энергией
между системой и окружающей средой (δm = 0; δE = 0). При протекании процесса не меняются масса вещества и энергия системы;
130
• закрытые (замкнутые) – при протекании процесса происходит обмен энергией между системой и окружающей средой. Обмен массой вещества отсутствует (δm = 0; δE ≠ 0);
• открытые (незамкнутые) – при протекании процесса происходит обмен между системой и окружающей средой как энерги-
ей, так и веществом (δm ≠ 0; δE ≠ 0).
Обмен энергией может происходить как в виде передачи теплоты, так и путем совершения работы.
Теплота – форма передачи кинетической энергии атомов и молекул от одного тела к другому, которая может осуществляться тремя способами: при непосредственном их соприкосновении – теплопередачей, при самопроизвольном механическом перемешивании газов или жидкостей с различным значением энергии – конвекцией, при испускании и поглощении электромагнитного излучения – лучеиспусканием. Условно принято считать, что теплота,
полученная от окружающей среды, положительна (δQ > 0), а теп-
лота, отданная системой, отрицательна (δQ < 0). Процессы, протекающие в системе без обмена теплотой с окружающей средой, на-
зываются адиабатическими (δQ = 0).
Работа при взаимодействии с окружающей средой может совершаться как самой системой против внешних сил, так и внешними силами против системы. Условно принято считать, что в
первом случае работа положительна (δW > 0), а во втором отри-
цательна (δW < 0).
В зависимости от состояния и свойств физических тел, образующих термодинамическую систему, различают гомогенные системы, все части которых обладают одинаковыми физикохимическими свойствами, и гетерогенные – системы, в которых можно выделить отдельные части, обладающие различными физи- ко-химическими свойствами, т. е. состоящие из нескольких фаз (две и более). Фаза – совокупность частей системы, которые обладают одинаковыми физико-химическими свойствами и отделены друг от друга поверхностью раздела (граница фазы).
Примеры гетерогенных систем:
•монокристалл, находящийся в контакте с газом (обе фазы непрерывны и имеют различный химический состав);
•кусочки льда, плавающие на поверхности воды (лед – прерывная фаза; обе фазы имеют одинаковый химический состав);
131
• смесь кристаллов, полученная механическим смешиванием или при кристаллизации (обе фазы прерывны и имеют различный химический состав).
Совокупность всех физических и химических свойств системы называется ее состоянием, которое характеризуется термодинамическими параметрами. Термодинамическим параметром может быть любое свойство системы, если оно рассматривается как одна из независимых переменных. Число независимых параметров, необходимое и достаточное для полного описания состояния системы, называется числом термодинамических степеней свободы.
Параметры состояния, которые можно определить непосредственно, принято считать основными. К ним относятся температура (термодинамическая шкала Кельвина) T (K), давление р (Па = = Н/м2), объем V (м3, л), количество вещества (число молей веще-
ства) ν, концентрация вещества C (моль/л; мольная доля). Считается, что термодинамическая система находится в со-
стоянии равновесия, если ни один из ее параметров не изменяется во времени и это состояние не поддерживается каким-либо внешним по отношению к системе воздействием. То есть давление во всех точках системы одинаково (механическое равновесие), температура тоже одинакова (термическое равновесие), химический и фазовый состав системы постоянен (химическое равновесие).
П р и м е ч а н и е. Система, находящаяся в состоянии равновесия, называется стабильной. В ряде случаев в системе, находящейся в неравновесном состоянии, сохраняются во времени значения термодинамических параметров. Это связано с тем, что скорость перехода системы в состояние равновесия практически равна нулю. Такие системы называются метастабильными. Например, при комнатной температуре метастабильными системами являются алмаз или смесь газообразного водорода и кислорода. Очевидно, что при соответствующем внешнем воздействии системы самопроизвольно перейдут в стабильное состояние.
Параметры системы, находящейся в состоянии равновесия, находятся в функциональной зависимости: изменение одного из параметров должно сопровождаться изменением других. Уравнения, связывающие термодинамические параметры системы в состоянии равновесия, называются уравнениями состояния.
Например, уравнение состояния ν молей идеального газа –
уравнение Менделеева−Клапейрона: рV = νRT.
Через термодинамические параметры определяют переменные
132
физические величины, характеризующие состояние системы, ко-
торые называются термодинамическими функциями. Их величины зависят только от начального и конечного состояния системы и не зависят от пути перехода из одного состояния в другое.
Наиболее часто для проведения термодинамических расчетов как химических, так и физических процессов используются следующие термодинамические функции состояния системы: U – внутренняя энергия; H – энтальпия; S – энтропия; G – энергия Гиббса; A – энергия Гельмгольца. Физический смысл каждой из функций будет рассмотрен в соответствующих разделах.
5.1.2. Термодинамический процесс
Один из постулатов термодинамики формулируется так: тер-
модинамическая система стремится перейти в состояние равновесия, в котором может находиться сколь угодно долго при отсутствии внешнего воздействия на нее.
Если на систему оказывается какое-либо внешнее воздействие, приводящее к обмену между нею и окружающей средой веществом или энергией, то система перейдет в другое состояние равновесия, характеризующееся другим набором параметров. Переход системы из одного состояния равновесия в другое называется
термодинамическим процессом, в ходе которого обязательно из-
меняется хотя бы один из параметров системы.
Процесс при постоянной температуре (Т = const) называется изотермическим, при постоянном объеме (V = const) – изохорическим (или изохорным), при постоянном давлении (р = const) – изобарическим (или изобарным). Процесс, в котором система возвращается в исходное состояние, называется круговым или циклическим.
Химический процесс, являющийся, по сути, совокупностью химических реакций, протекает с изменением количеств веществ. Пусть система, состоящая из вещества А, находится в состоянии термодинамического равновесия 1. При добавлении в эту систему вещества В (воздействие на систему извне) она должна перейти в новое состояние равновесия. Одним из путей перехода является химическая реакция между веществами А и В с образованием продуктов C и D:
νаA + νbB → νсC + νdD.
133

Если между веществами C и D протекает реакция с образовани-
ем веществ А и В: νсC + νdD → νаA + νbB, то в состоянии равновесия 2 термодинамическая система будет состоять из смеси веществ A, B, C и D в соответствующих количествах. Химическая реакция запишется следующим образом:
νаA + νbB ↔ νсC + νdD.
Если на данную систему было оказано воздействие извне (обмен энергией или веществом), то это приводит к переходу системы в состояние равновесия 3 с другим количеством веществ A, B, C и D. Причем не очевидно, в каком направлении будет протекать химическая реакция, приводящая систему в состояние равновесия 3. Условились считать, что реакция протекает в прямом направлении, если количество исходных веществ (в нашем случае А и В) уменьшается, а количество продуктов реакции (в нашем случае C и D) увеличивается. Говорят, что реакция протекает в обратном направлении, если увеличивается количество исходных веществ при соответствующем уменьшении количества продуктов. Если реакция в системе может протекать в прямом и обратном направлении, то говорят, что она обратимая.
Очевидно, что для обратимых реакций «исходные реагенты и продукты реакции» – понятия условные и зависят от того, как записана реакция. При изменении записи химической реакции они меняются:
исходные вещества |
νаA + νbB ↔ νсC + νdD, |
продукты реакции |
νсC + νdD ↔ νаA + νbB. |
Процессы бывают самопроизвольными и несамопроизвольными (вынужденными). Самопроизвольные – процессы, для протекания которых не требуются затраты энергии из окружающей среды. Примеры – переход теплоты от нагретого тела к холодному или процесс смешения газов. Несамопроизвольные – процессы, для протекания которых необходимы затраты энергии из окружающей среды. Пример – разделение газовых смесей.
По характеру перехода термодинамической системы из одного состояния равновесия в другое процессы делятся на равновесные (обратимые) и неравновесные (необратимые).
Равновесный (обратимый) процесс представляет собою бесконечную последовательность отдельных состояний равновесия. Система как бы все время находится в состоянии равновесия (ква-
134
зистатический процесс). Его можно в любой момент заставить протекать в обратном направлении по тому же самому пути, изменив какой-либо параметр на бесконечно малую величину. Очевидно, что если время перехода системы в новое состояние равнове-
сия (τ) будет много меньше, чем время воздействия на систему (t)
(τ << t), то можно считать, что в каждый момент времени система будет находиться в термодинамическом равновесии, что и является условием обратимости процесса. Такие процессы суть идеализация реальных процессов, экспериментально к ним можно только приблизиться, но никогда нельзя достигнуть. Если равновесный процесс провести сначала в прямом направлении, а затем в обратном, то система пройдет через те же состояния равновесия и не обнаружится никаких изменений как в самой системе, так и в окружающей среде. Работа, совершаемая системой в прямом процессе (W12), будет равна работе, необходимой для возврата системы в исходное состояние (W21). Работы прямого и обратного процессов равны по абсолютной величине и противоположны по знаку: W12 = –W21 (условие термодинамической обратимости процесса).
В неравновесных (необратимых) процессах время перехода системы в состояние равновесия много больше, чем время воздей-
ствия на нее (τ >> t). Поэтому в системе не устанавливается термодинамическое равновесие в промежуточных стадиях и они не совпадают при прямых и обратных переходах. Работа, совершаемая системой в неравновесных процессах при переходе из одного состояния равновесия в другое (W12), не равна работе, необходимой для возврата системы в исходное состояние (W21). Если система совершала работу в прямом процессе, то для ее возврата в исход-
ное состояние требуется бόльшая работа: W12< W21. Если в прямом процессе внешние силы совершали работу над системой, то при возвращении в исходное состояние термодинамическая система совершит меньшую работу: W12>W21. Отметим, что работа, совершаемая системой в термодинамически обратимых процессах, является максимально возможной.
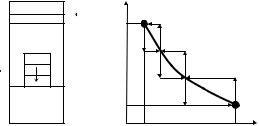
П р и м е р. Процесс изотермического расширения идеального газа. Начальное (первое) состояние системы: идеальный газ при температуре Т находится под поршнем, нагруженным тремя гирями (рис. 5.2), давление в системе р1, занимаемый объем V1. Конечное (второе) состояние системы: идеальный газ при температуре Т находится под разгруженным поршнем, давление в системе р2, за-
135
нимаемый объем V2. Работа, совершаемая идеальным газом при переходе из первого состояния во второе, зависит от характера воздействия на систему. В случае бесконечно медленного снятия
нагрузки с поршня (τ << t) система все время находится в состоянии равновесия, которое описывается уравнением Менделеева−Клапейрона. В этом случае элементарная работа, совершаемая системой, равна:
dW = pdV = νRT dVV . p
p1
р2 V2 T
mg
|
p2 |
р1 V2 T |
1
T - const
|
2 |
V1 |
V2 V |
Рис. 5.2. Процесс расширения (1-2) и сжатия (2-1) идеального газа
Тогда работы при переходе системы из состояния 1 в состояние 2, и обратно из 2 в 1, равны по величине и противоположны по знаку:
V |
|
= νRT ln V2 |
|
|
W12 = ∫2 νRT dV |
, |
|||
V |
V |
|
V1 |
|
1 |
|
|
|
|
V |
|
|
|
|
W21 = ∫1 νRT dV |
= νRT ln |
V1 |
, |
|
V2 |
V |
|
V2 |
|
Wравн = W12 = W21 .
Работа, совершаемая при переходе системы из одного состояния в другое, равна площади под кривой, описывающей этот переход, в координатах р-V (см. рис. 5.2).
В случае ступенчатого перехода системы из состояния 1 в состояние 2 (время разгрузки системы меньше, чем время установ-
ления равновесия в системе – τ >> t) работа, совершаемая идеальным газом, меньше, чем при реализации того же процесса в равновесных условиях (площадь под ломаной линией меньше): W12
136
