
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
изведение молярных концентраций ионов водорода и гидроксоионов – величина постоянная:
KW = [H+][OH–] = 1,0 10-14 (моль/л)2 при Т = 298 К.
Эта константа называется ионным произведением воды (KW).
Его величина не зависит от концентрации ионов водорода или гидроксо-ионов, поэтому для определения кислотности или щелочности раствора достаточно указать концентрацию одного из ионов. Таким ионом был выбран ион водорода. Если концентрация ионов водорода равна концентрации гидроксо-ионов, то считается, что среда нейтральная – чистая вода или водные растворы, не со-
держащие кислот или оснований:
[H+] = [OH–] = 10-7 моль/л.
В кислой среде (растворы кислот) концентрация ионов водорода больше концентрации гидроксо-ионов: [H+] > 10-7 моль/л. В щелочной среде (растворы щелочей) концентрация гидроксо-ионов больше концентрации ионов водорода: [H+] < 10-7 моль/л. Для удобства концентрацию ионов водорода указывают в виде специальной характеристики – водородного показателя.
Водородный показатель pH (произносится как «пэ аш») – десятичный логарифм концентрации ионов водорода, взятый с обратным знаком: pH = –lg[H+]. В нейтральной среде pH = 7, в кислой pH < 7, в щелочной pH > 7.
Аналогично водородному показателю pH существует показатель pОH = –lg[ОH–]. Очевидно, что pH+pОH = 14.
7.4.4. Растворы кислот и оснований
При диссоциации кислот или оснований устанавливаются равновесия:
HAn ↔ H+ + An-, KatOH ↔ Kat+ + OH-,
где Kat+ – катион; An− – анион.
Процессу диссоциации соответствуют константы равновесия: для кислот Ka (acid – кислота), а для оснований Kb (base – основание):
Kа = |
[H+][An−] |
, |
Kb = |
[Kat+][OH−] |
. |
|
[HAn] |
[KatOH] |
|||||
|
|
|
|
Величины констант диссоциации приводятся в справочной литературе.
240

Для слабых электролитов (α → 0) концентрация вещества в недиссоциированной форме примерно равна общей концентрации растворенного вещества. Согласно уравнению диссоциации концентрации катионов и анионов равны: [H+] = [An−]; [Kat+] = [OH−] (в результате единичного акта диссоциации получается один катион и один анион). Тогда константы диссоциации соответственно равны:
Ka ≈ |
[H+]2 |
, |
Kb ≈ |
[OH−]2 . |
|
C |
|
|
C |
|
кисл |
|
|
осн |
Из уравнений следует, что
[H+]=
 KaСкисл , [OH−]=
KaСкисл , [OH−]=
 KbСосн .
KbСосн .
Соответственно раствор кислоты концентрацией Скисл моль/л имеет
pH =−lg[
 KaCкисл ],
KaCкисл ],
а раствор основания концентрацией Сосн моль/л
pH =14+lg[
 KbCосн] .
KbCосн] .
Концентрация ионов водорода и, соответственно, рН сильных кислот и оснований (α → 1) рассчитывается, как правило, через степень диссоциации. Концентрации ионов водорода будут соот-
ветственно равны: в растворе кислоты [H+] = αCкисл, в растворе
щелочи [OH–] = αCосн [H+] = 10–14/[OH–].
Таким образом, раствор кислоты концентрацией Скисл моль/л имеет
рН = –lg[αСкисл],
а раствор основания концентрацией Сосн моль/л
pH = 14 + lg[αCосн].
Многоосновные кислоты и основания диссоциируют ступенчато, причем константа диссоциации каждой последующей ступени на несколько порядков меньше предыдущей. Поэтому расчет рН таких растворов обычно проводят по первой ступени диссоциации.
7.4.5.Буферные растворы
Вводном растворе слабых кислот или оснований устанавливается равновесие, которому соответствуют равновесные значения концентраций ионов и недиссоциированных молекул:
241
HAn ↔ H+ + An-, KatOH ↔ Kat+ + OH-.
Изменение концентрации одного из ионов в растворе смещает равновесие. Изменение концентрации ионов H+ вызывается добавлением сильной кислоты, ионов ОH− – добавлением сильного основания, катионов металла (Kat+) и анионов кислот (An−) – добавлением растворимых солей, содержащих соответствующие ионы.
На практике большое значение имеют растворы, содержащие слабую кислоту или слабое основание и соль этой же кислоты или основания:
HAn + KatAn, KatOH + KatAn.
Они получили название буферные растворы, поскольку обладают свойством незначительно изменять величину pH при добавлении в них кислоты или щелочи. Это связано с тем, что рН этих растворов (равновесная концентрация ионов водорода) будет определяться концентрацией не только кислоты или основания, но и соли. Например, буферный раствор содержит слабую кислоту HAn (концентрация – Ск) и соль этой кислоты (концентрация – Сс). Концентрация ионов водорода определяется диссоциацией кислоты:
+ |
- |
Kа = |
[H+][An−] |
. |
HAn ↔ H |
+ An , |
[HAn] |
||
|
|
|
|
Поскольку в растворе присутствует соль, которая является
сильным электролитом (α → 1), то концентрация анионов в растворе будет определяться в основном анионами, получающимися в
результате диссоциации соли, а не слабой кислоты (α → 0): KatAn ↔ Kat+ + An-.
Поэтому можно считать, что концентрация анионов будет равна концентрации соли:
[An−] ≈ Сс..
Поскольку [Н+] << [An−], то равновесие смещено в сторону образования недиссоциированных молекул кислоты. Поэтому тем более можно считать, что их концентрация равна концентрации кислоты:
[HAn] ≈ Ск .
Концентрация ионов водорода в буферном растворе будет зависеть от соотношения концентраций соли и кислоты:
242

K |
а |
= |
[H+] С |
c |
→ |
[H |
+ |
]=K |
С |
к . |
С |
|
|
||||||||
|
|
|
|
|
|
|
a С |
с |
||
|
|
|
к |
|
|
|
|
|
|
Добавление к буферному раствору кислоты или щелочи приводит к незначительному сдвигу установившегося в системе равновесия. Так, добавление ионов H+ ([H+] << Cc) вызовет их д о- полнительную ассоциацию с анионами. При этом концентрация кислоты в недиссоциированной форме и концентрация соли изменятся слабо, соответственно практически не изменится величина pH. Добавленные ионы OH− ([ОH−] << Cк) будут связывать-
ся ионами водорода (OH−+H+ → H2О). Уменьшение их концентрации будет скомпенсировано в результате диссоциации слабой кислоты.
Аналогичные процессы протекают в буферных растворах, содержащих слабое основание и соответствующую соль. В этом случае концентрация ионов ОH− будет равна:
[OH−]=Kb Сосн .
Сс
Очевидно, что количество сильной кислоты или основания, незначительно меняющих рН буферного раствора, ограничено. Характеристикой способности буферного раствора сохранять значение рН является емкость буфера, которая равна количеству кислоты или основания, необходимому для изменения pH раствора на единицу.
7.4.6. Гидролиз солей
Водные растворы солей являются электролитами, в которых молекулы соли практически полностью диссоциированы на ионы:
KatAn → Kat+ + An−.
Катионы и анионы соли будут вступать во взаимодействие с ионами H+ и OH−, образовавшимися при диссоциации воды. Система придет в равновесие в результате установления равновесия в каждой реакции, которым будут соответствовать свои константы равновесия:
+ |
− |
|
1 |
|
|
H |
+ An |
↔ HАn |
K = |
|
, |
Ka |
|||||
243
|
+ |
− |
1 |
|
|
Kat |
|
+ OH ↔ KatOH |
K = |
|
, |
|
Kb |
||||
H2O ↔ H+ + OH− KW.
В зависимости от величин констант диссоциации кислоты (Ка) и основания (Кb) равновесие в растворе будет смещено либо в сто-
рону образования молекул кислот и оснований, либо в сторону образования ионов. Таким образом, если соль образована катионом слабого основания или анионом слабой кислоты, то суммарные уравнения реакций могут быть записаны в виде
Kat+ + H2O ↔ KatOH + H+ |
Kг = |
KW |
, |
||
|
|
||||
|
|
|
Kb |
||
An- + H2O ↔ HAn + OH− |
Kг = |
KW |
. |
||
|
|||||
|
|
Ka |
|||
Реакции такого типа называются реакциями гидролиза солей. Им соответствуют константы равновесия (Кг), которые называются константами гидролиза.
Гидролиз приводит к изменению химического состава раствора. В нем, кроме катионов и анионов соли, будут присутствовать молекулы слабых кислот и оснований. Гидролиз солей, образованных многоосновными кислотами или многокислотными основаниями, протекает ступенчато. В этом случае в растворе будут присутствовать также гидроанионы или гидроксокатионы. Константы гидролиза каждой последующей ступени будут много меньше, чем предыдущей. Поэтому, как правило, описание гидролиза можно ограничить первой ступенью.
Аналогично степени диссоциации используют понятие степени гидролиза как доли количества молекул соли, подвергшихся гид-
ролизу (h=Сг 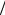 С0 ). Как и степень диссоциации, степень гидролиза
С0 ). Как и степень диссоциации, степень гидролиза
растет при уменьшении концентрации соли.
Гидролизу подвержены все соли, образованные с участием ионов слабых электролитов. В большей степени гидролизуются соли, образованные одновременно катионом слабого основания и анионом слабой кислоты. Также ему способствует вывод из реакционного объема продуктов (образование газа или осадка).
Как видно из приведенных уравнений, гидролиз изменяет рН раствора. Раствор соли, образованной катионом слабого основания и анионом сильной кислоты, в результате гидролиза приобретает
244
кислый характер среды (pH<7). В случае катиона сильного основания и аниона слабой кислоты раствор соли имеет щелочной характер (pH > 7).
П р и м е р.
1.Соли, образованные катионом сильного основания и анионом
сильной кислоты: NaCl, KNO3, K2SO4, … Гидролиза не происходит, pH = 7.
2.Соли, образованные катионом слабого основания и анионом сильной кислоты: CuSO4, NH4Cl, Co(NO3)2, …
Cu2+ + H2O ↔ CuOH+ + H+ pH<7,
2 CuSO4+ 2 H2O ↔ [CuOH]2SO4 + H2SO4.
3. Соли, образованные катионом сильного основания и анионом слабой кислоты: Na3РO4, KCN, Na2CO3, …
РO43- + H2O ↔ HРO42-+ OH- pH>7, Na3РO4+ H2O ↔ Na2HРO4+ NaOH.
4. Соли, образованные катионом слабого основания и анионом слабой кислоты: Al2S3, NH4NO2, Ag2CO3…
Al3++ H2O↔AlOH2+ + H+ → AlOH2++ H2O↔Al(OH)2+ + H+ →
→ Al (OH)2++ H2O↔Al(OH)3↓ + H+,
S2- + H2O ↔ HS-+ OH- → HS-+ H2O ↔ H2S↑ + OH- , Al2S3 + 6 H2O ↔ 2 Al(OH)3↓+ 3 H2S↑ pH ≈7.
Если известна молярная концентрация соли (Cc) и константы диссоциации слабой кислоты (Ка) или основания (Кb), то можно оценить величину pH раствора соли и степень гидролиза (h).
Kat++H2O↔KatOH+H+
|
K |
[KatOH][H+] |
|
|
[H+]2 |
|
[H+] |
|
|
|
||||
Kг = |
W |
= |
[Kat+] |
|
≈ |
Cc |
h= |
|
C0 |
100% |
, |
|||
|
|
|
||||||||||||
|
Kb |
|
|
|
|
|
|
|
|
|||||
An-+H2O↔HAn+OH- |
|
|
|
|
|
|
[OH- ] |
|
|
|||||
|
K |
[HAn][OH−] |
|
|
[OH−]2 |
|
|
|
|
|||||
Kг = |
W |
= |
[An−] |
≈ |
|
Cc |
h= |
C0 |
100% . |
|||||
|
|
|||||||||||||
|
Ka |
|
|
|
|
|
|
|
||||||
П р и м е р. Оценить pH раствора CuSO4, Cc = 0,1 моль/л,
Кb2=2,19∙10-7
Cu2+ + H2O ↔ CuOH+ + H+ , pH<7,
2 CuSO4+ 2 H2O ↔ [CuOH]2SO4 + H2SO4.
245
