
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
С увеличением кратности связи увеличивается энергия связи и уменьшается ее длина.
П р и м е р. Характеристики химических связей различной кратности приведены в табл. 3.1.
|
|
|
Т а б л и ц а 3.1 |
Связь |
Кратность |
Энергия, кДж/моль |
Длина, Ǻ |
C−C |
Простая |
342 |
1,54 |
C=C |
Двойная |
600 |
1,34 |
C≡C |
Тройная |
826 |
1,20 |
F−F |
Простая |
155 |
1,42 |
O=O |
Двойная |
494 |
1,21 |
N≡N |
Тройная |
942 |
1,10 |
Cl-Cl |
Простая |
239 |
1,99 |
Br-Br |
Простая |
190 |
2,28 |
3.2.3. Геометрия простейших молекул. Гибридизация АО
Вследствие того, что общая электронная пара локализована в области перекрывания атомных орбиталей, взаимное расположение атомов в молекуле будет определяться пространственной ориентацией валентных орбиталей.
Рассмотрим, например, пространственное строение молекул, образованных двумя атомами водорода и атомами халькогенов: кислорода, серы и селена (H2O, H2S, H2Se). В атомах водорода валентным является s-электрон (H 1s1), а в атомах халькогенов – два неспаренных p-электрона (O, S, Se − ns2npx2py1pz1). Атом халькоге-
на в этих молекулах образует две σ-связи с атомами водорода в ре- |
||||
зультате перекрывания py- и pz-орбиталей с s-орбиталями. py- и pz- |
||||
орбитали располагаются относительно |
|
z |
|
|
друг друга под углом 90о, поэтому угол |
|
s |
||
|
+δ |
|||
связи (валентный угол) должен быть |
|
|||
|
|
|
||
равен этой величине (рис. 3.9). |
px |
|
|
|
Величина валентного угла зависит |
|
s |
||
также от электростатического взаимо- |
|
|
||
действия зарядов, возникающих на |
py |
|
y |
|
атомах молекулы в результате поляри- |
−δ |
+δ |
||
зации связи. На атомах водорода воз- |
|
pz |
x |
|
никает эффективный положительный |
|
|||
заряд δ+, величина которого прямо |
Рис. 3.9. Схема перекрыва- |
|||
пропорциональна |
электроотрицатель- |
ния |
атомных |
орбиталей в |
ности халькогенов. Электростатиче- |
молекуле халькогенводорода |
|||
78 |
|
|
|
|
ское взаимодействие атомов водорода приводит к увеличению уг-
ла связи, причем тем больше, чем больше δ+. Следовательно, максимальное отклонение валентного угла от 90о должно быть в молекуле H2O, а минимальное – в молекуле H2Se. Экспериментально полученные величины валентных углов в этих молекулах и электроотрицательности халькогенов представлены ниже:
|
χ халькогена (по Полингу) |
Валентный угол |
H2O......................... |
3,5 |
104,5о |
H2S.......................... |
2,6 |
92,2о |
H2Se........................ |
2,4 |
91,0о |
В ряде случаев описание химической связи в молекулах с использованием «обычных» атомных орбиталей вступало в противоречие с экспериментальными данными. Например, в молекуле BeH2 атом бериллия на внешнем уровне имеет два спаренных s- электрона (2s2). Для образования связи с двумя атомами водорода атом бериллия должен иметь два неспаренных электрона. Это возможно при переходе одного электрона на p-орбиталь (возбужденное состояние – 2s12px1). В этом случае в молекуле BeH2 связи меж-
ду атомами бериллия и водорода должны быть разными (σs-s и σs-p). Эксперимент показывает, что в химическом плане оба атома водорода равноценны, т.е. химические связи междуними одинаковы.
Такого рода противоречия были разрешены с развитием Лайну-
сом Полингом и Джоном Слэтером теории гибридизации атом-
ных орбиталей. Было показано, что если в образовании атомом химической связи принимают участие орбитали различной симметрии, не сильно различающиеся по энергии, то при описании химической связи они могут быть заменены таким же числом равноценных гибридных орбиталей.
При построении гибридных волновых функций выполняются следующие правила:
1. Волновая функция, описывающая гибридную орбиталь, представляет собой сумму исходных атомных волновых функ-
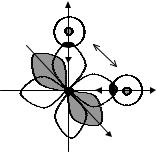
ций:Ψгиб =∑ci Ψi , где сi – нормирующие множители, учитывающие вклад каждой атомной орбитали. Соответственно гибридные орбитали имеют определенную пространственную конфигурацию, отличную от атомных (рис. 3.10).
2. Энергия всех гибридных орбиталей одинакова. Их суммарная энергия меньше, чем суммарная энергия исходных атомных орбиталей. При гибридизации энергия системы понижается.
79
3.Число гибридных орбиталей равно числу исходных атомных орбиталей. Максимальное число гибридных орбиталей с участием s-, p- и d-электронов не может быть больше шести.
4.При образовании химической связи возможны случаи, когда гибридизуются не все валентные электроны. Как правило, гибрид-
ные орбитали образуют σ-связи и в основном определяют пространственную ориентацию соседних атомов (геометрию молекулы), а негибридные могут образовывать дополнительные связи
(например, π-связи).
s –орбиталь |
p-орбиталь |
p-орбиталь |
|
d-орбиталь |
|
|
|
sp-гибридная орбиталь
pd-гибридная орбиталь
Рис. 3.10. Схема образования sp- и pd-гибридных орбиталей
Приведем примеры различных случаев гибридизации.
1. sp-гибридизация: одна s- и одна p-орбиталь образуют две гибридные sp-орбитали расположенные под углом 180° (линейная симметрия):Ψsp =c1 Ψs +c2 Ψpx .
П р и м е р. Молекула BeH2 (Be - 2s2; возбужденное состояние Be* - 2s12px1; H - 1s1) линейна, все три атома лежат на прямой, атом бериллия в центре. Он образует две σ-связи с двумя атомами водорода в результате перекрывания двух sp-гибридных орбиталей с s-орбиталями атомов водорода (рис. 3.11).
H H
Be
Рис. 3.11. Схема образования связи в молекуле BeH2
2. sp2-гибридизация: одна s- и две p-орбитали (px py) образуют три sp2-гибридные орбитали ( Ψsp2 =c1 Ψs +c2 Ψpx +c3 Ψp y ), ле-
80
жащие в одной плоскости и направленные относительно друг друга под углом 120о.
|
|
|
П р и м е р. Молекула BF3 |
|
|
F |
(B 2s22px1; возбужденное состояние |
|
|
B*2s12px12py1; F 2s22p5) представляет |
|
|
|
|
собой плоский равносторонний тре- |
|
B |
120o |
угольник с атомом бора в центре и |
|
|
тремя атомами фтора в вершинах. |
|
|
|
|
Атом бора образует три σ-связи с |
F |
|
F |
тремя атомами фтора в результате |
|
|
|
перекрывания трех sp2-гибридных |
Рис. 3.12. Схема образования |
орбиталей с p-орбиталями атомов |
||
|
связи в молекуле BF3 |
фтора, на которых находятся неспа- |
|
|
ренные электроны (рис. 3.12). |
||
|
|
|
|
3. sp3-гибридизация: одна s- и три p-орбитали образуют четыре
sp3-гибридные орбитали (Ψ |
3 |
=c Ψ +c Ψ |
px |
+c Ψ |
py |
+c Ψ |
pz |
), |
||
sp |
|
1 |
s |
2 |
3 |
4 |
|
|||
направленные в вершины тетраэдра (многогранника, образованного четырьмя равносторонними треугольниками). Угол между осями гибридных орбиталей 109о29' (рис. 3.13).
sp3 – гибридная орбиталь
Рис. 3.13. Схема ориентации в пространстве четырех sp3-гибридных орбиталей
П р и м е р. Молекула CH4 (C 2s22px12py1; возбужденное состояние C* 2s12px12py12pz1; H1s1) – тетраэдр, в центре которого располагается атом углерода, а в вершинах – четыре атома водорода.
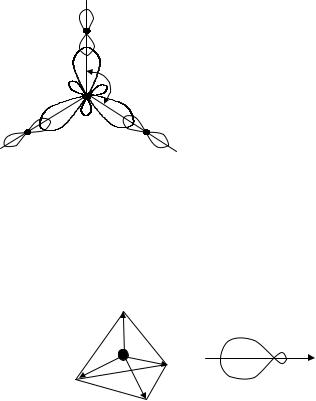
4. dsp2-гибридизация: одна s-, одна d- и две p-орбитали образу-
ют четыре |
dsp2-гибридные орбитали (Ψ |
2 |
=c Ψ +c |
2 |
Ψ |
px |
+ |
|||||
|
|
|
|
|
dsp |
|
1 |
s |
|
|
||
+c3 Ψpy +c4 |
Ψd |
x |
2 |
−y |
2 ), лежащие в одной плоскости, направленные |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||
относительно друг друга под углом 90о (рис. 3.14).
П р и м е р. Ион [CuCl4]-2 представляет собой плоский квадрат,
81
