
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
5.2.3. Тепловой эффект химической реакции
При протекании химической реакции происходит перестройка химических связей в молекулах, переход из одного агрегатного состояния в другое и т.д. Все это приводит к изменению внутренней энергии системы. При этом система может совершать работу и обмениваться энергией с окружающей средой. Поскольку все виды энергии можно свести к эквивалентному количеству теплоты, то в химической термодинамике говорят о тепловом эффекте химической реакции.
Тепловой эффект химической реакции – количество теплоты,
которое выделяется или поглощается в ходе реакции при выполнении следующих условий:
•процесс протекает необратимо при постоянном объеме или давлении;
•в системе не совершается никаких работ, кроме работы расширения;
•продукты реакции имеют ту же температуру, что и исходные вещества.
Согласно первому началу термодинамики тепловой эффект ре-
акции равен: ∆Q = ∆U + p∆V. Поскольку теплота не является функцией состояния, то величина теплового эффекта химической реакции зависит от условий осуществления (пути) процесса. Различают тепловой эффект химической реакции, проведенной в изо-
хорных условиях (∆QV = ∆UV) и в изобарных (∆Qp = ∆Up + p∆V = =∆Н). Очевидно, что ∆Qp – ∆QV = p∆V. Для реакций, протекающих
в конденсированной фазе (жидкости, твердые вещества), ∆V≈0, а
∆Qp ≈ ∆QV.
Чаще всего химические реакции проводят при постоянном давлении, поэтому при проведении термодинамических расчетов обычно используют тепловой эффект при постоянном давлении
(∆Qp). В этом случае он соответствует изменению энтальпии сис-
темы в ходе реакции ∆Qp = ∆rН (индекс r указывает на изменение термодинамической функции, в данном случае энтальпии, в ходе химической реакции).
Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими, а реакции, протекающие с поглощением теплоты из окружающей среды, – эндотермически-
141
ми. Так как тепловой эффект реакции соответствует изменению энтальпии системы, то очевидно, что для экзотермических процес-
сов ∆rН<0, а для эндотермических ∆rН>0.
Поскольку для химических реакций, протекающих в изобарных или изохорных условиях, теплота приобретает свойства функции состояния, то можно утверждать, что тепловой эффект реакции зависит только от вида и состо яния исходных веществ и конечных продуктов и не зависит от пути превращения одних веществ в другие (промежуточных стадий). Это утверждение можно рассматривать как приложение первого начала термодинамики к химическим реакциям. Оно называется законом Гесса и является основным законом термохимии.
Г.И. Гесс (СПб Академия наук) опытным путем установил, что «если из одних исходных веществ можно получить некоторые другие вещества несколькими способами, то суммарное количество тепла, выделившееся при образовании этих веществ, будет всегда одним и тем же, независимо от способа получения».
Рассмотрим реакцию взаимодействия одного моля углерода (графит) и кислорода с образованием диоксида углерода при температуре Т = 298 K.
Данный процесс можно осуществить двумя путями:
1) |
C(графит) + O2 = CO2; |
∆rН1 = –393,51 кДж; |
|
2) |
C(графит) + 0,5O2 = CO; |
∆rН2 |
= –110,53 кДж; |
|
CO + 0,5O2 = CO2; |
∆rН3 |
= –282,98 кДж. |
|
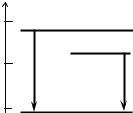
Диаграмма изменения энтальпии системы приведена на рис.5.3. |
||
Из нее видно, что ∆rН1 = ∆rН2 + ∆rН3. Если неизвестен тепловой эффект
одной из реакций, то его можно вычислить, зная остальные. Например, если известны ∆rН1 и ∆rН3, то
∆rН2 = ∆rН1 – ∆rН3.
Таким образом, используя закон Гесса, можно рассчитывать тепловые эффекты химических реакций в тех случаях, когда их экспериментальное определение невозможно или затруднено. Более того, на основе имеющихся экспериментальных данных
∆Н
C(графит); O2
CO; O2 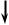 ∆rН2
∆rН2
∆rН1 ∆rН3
CO2
Рис. 5.3. Диаграмма изменения
энтальпии системы при взаимодействии одного моля углерода с кислородом с образованием диоксида углерода
142
для относительно небольшого числа химических реакций можно проводить термодинамические расчеты как реально протекающих, так и гипотетических процессов.
Тепловой эффект реакции в общем случае учитывает переход определенного числа молей исходного вещества в определенное число молей конечного вещества, согласно уравнению реакции. В этом случае численное значение теплового эффекта относится к уравнению конкретной химической реакции и его размерность − кДж. Уравнение химической реакции, включающее в себя ее теп-
ловой эффект, называется термохимическим уравнением.
Часто тепловой эффект реакции относят к превращениям одного моля какого-либо вещества. Стехиометрический коэффициент в уравнении реакции у данного вещества равен единице, а коэффициенты у других веществ могут быть как целыми, так и дробными.
В этом случае размерность теплового эффекта − кДж/моль. Принято тепловые эффекты реакций образования одного моля вещества обозначать ∆fН, а тепловые эффекты реакций сгорания одного мо-
ля вещества – ∆cН.
П р и м е р. Химическое взаимодействие между алюминием и кислородом можно представить в виде трех термохимических уравнений:
4 Al + 3 O2 = 2 Al2O3 + ∆rН,
тепловой эффект реакции ∆rН= –3352,2 кДж;
2 Al + 3/2 O2 = 1 Al2O3 + ∆fН,
тепловой эффект образования одного моля Al2O3 ∆fН = = –1676,1 кДж/моль;
1 Al + 3/4 O2 = 1/2 Al2O3 + ∆cН,
тепловой эффект сгорания одного моляAl ∆cН = –838,05 кДж/моль.
5.2.4. Термохимические расчеты
Поскольку величины внутренней энергии, а следовательно, и энтальпии системы зависят от термодинамических параметров (температуры, давления, количества вещества), то для термохимических расчетов необходимо привести тепловые эффекты реакций к одинаковым условиям. Чаще всего используют так называемые
стандартные условия: давление p0 = 1,013 105 Па, температура Т0 = 298,15 K. Этим условиям соответствуют стандартные тепло-
143
вые эффекты химических реакций, которые обозначают ∆rН0298. Иногда в целях упрощения записи, когда ясно, что речь идет о стандартных условиях, нижний индекс, указывающий температуру, опускают. Если температура отлична от стандартной, то нижний индекс показывает, к какой температуре относится тепловой эффект ∆rН0Т.
Наиболее удобными для экспериментального определения тепловых эффектов являются реакции образования сложных веществ из простых и реакции сгорания сложных веществ в кислороде. Значения стандартных тепловых эффектов этих реакций приведены в справочной литературе.
Энтальпия образования веществ. Условились, что стандарт-
ная энтальпия образования простых веществ, находящихся в устойчивом состоянии (наиболее устойчивая модификация), принимается равной нулю.
П р и м е р. Водород при стандартных условиях газ, энтальпия
образования газообразного водорода ∆fН0298= 0 кДж/моль.
Ртуть при стандартных условиях − жидкость, энтальпия обра-
зования жидкой ртути ∆fН0298= 0 кДж/моль.
Углерод при 298 K может существовать в нескольких модификациях, например в виде графита и алмаза. Так как графит устой-
чивее алмаза, то (∆fН0298)графит = 0 кДж/моль, а ( ∆fН0298)алмаз = = 1,83 кДж/моль.
Тогда стандартная энтальпия образования сложных веществ (теплота образования) является количеством теплоты, которое поглощается или выделяется при образовании в стандартных условиях одного моля сложного вещества из простых веществ, взятых в наиболее устойчивой модификации:
1/2 А2 + 1/2 В2 = АВ + ∆fН0298.
Стандартная энтальпия образования веществ обозначается ∆fН0298 [кДж/моль]; индекс f происходит от англ. formation – образование. Известные значения стандартных энтальпий образования веществ приведены в справочной литературе, в разделе «термодинамические характеристики веществ».
Теплота сгорания – количество теплоты, которое выделяется при полном сгорании одного моля вещества при стандартных условиях. Полным сгоранием является реакция взаимодействия исходного вещества и кислорода с образованием продуктов окисле-
144

ния атомов, входящих в молекулу вещества. Принято считать, что продуктами окисления углерода, водорода, азота, галогенов (Hal), металлов (Ме) будут являться соответственно CO2, H2O (жид-
кость), N2, HHal, MexOy.
П р и м е р. Реакция полного сгорания вещества CcHhNnOoFf : CcHhNnOoFf + x O2 = c CO2 + ( h2 − f ) H2O + n2 N2 + f HF.
Стандартная энтальпия сгорания веществ обозначается ∆сН0298, [кДж/моль]; индекс с происходит от английского combustion – сгорание.
Следствия из закона Гесса. Теплоты образования и сгорания веществ широко используют при определении тепловых эффектов химических реакций. Расчеты проводят на основании следствий из закона Гесса.
Первое следствие: тепловой эффект реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом числа молей реагирующих веществ:
∆rН0298 = (∑ νi∆fН0i)продукты – (∑ νi∆fН0i)исх. вещества.
Для реакции νаA + νbB = νсC + νdD тепловой эффект рассчитывается по уравнению
∆rН0298 = (νc ∆fН0C + νd ∆fН0D ) – (νa ∆fН0A + νb ∆fН0B ).
Второе следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом числа молей реагирующих веществ:
∆rН0298 = (∑ νi ∆cН0 i) исх. вещества – (∑ νi ∆cН0 i ) продукты.
Для реакции νаA + νbB = νсC + νdD тепловой эффект рассчитывается по уравнению
∆rН0298 = (νa ∆сН0A + νb ∆сН0B) – (νc ∆сН0C + νd ∆сН0D).
П р и м е р 1. Определение стандартного теплового эффекта реакции, если известны теплоты образования веществ.
А. Реакция образования сульфата алюминия из оксида алюминия и триоксида серы: Al2O3 (кр) + 3SO3 (газ) = Al2(SO4)3 (кр).
Вещество |
Al2O3 (кр) |
SO3 (газ) |
Al2(SO4)3 (кр) |
∆fН0298, кДж/моль |
–1676,1 |
–395,9 |
–3442,8 |
Решение. Тепловой эффект реакции определяем по первому следствию из закона Гесса. В соответствии с уравнением реакции
145

∆rН0298 = (1 ∆fН0Al2(SO4)3) – (1 ∆fН0Al2O3 + 3 ∆fН0SO3 ) =
= 1 (–3442,8) – [1 (–1676,1) + 3(–395,9)] = –579 кДж.
Б. Реакция взаимодействия метана и диоксида углерода с образованием оксида углерода и водорода:
CH4 (газ) + CO2 (газ) = 2 CO (газ) + 2H2 (газ).
Вещество |
CH4 (газ) |
CO2 (газ) |
CO (газ) |
H2 (газ) |
∆fН0298, |
–74,85 |
–393,51 |
–110,5 |
0 |
кДж/моль |
|
|
|
|
Решение. Тепловой эффект реакции определяем по первому следствию из закона Гесса. В соответствии с уравнением реакции
∆rН0298 = (2 ∆fН0CO + 2 ∆fН0H2) – (1 ∆fН0CH4 + 1 ∆fН0CO2) =
=[2(–110,5) + 2 0] – [1(–74,85) + 1(–393,51)] = 247,36 кДж.
П р и м е р 2. Определение стандартного теплового эффекта реакции, если известны стандартные теплоты сгорания веществ.
Реакция взаимодействия уксусной кислоты и этилового спирта с образованием сложного эфира – этилацетата:
CH3COOH(ж)+C2H5OH(ж)=CH3COOC2H5(ж) + H2О(ж)
Вещество |
CH3COOH(ж) |
C2H5OH(ж) |
CH3COOC2H5(ж) |
H2О(ж) |
∆cН0298, |
–873,79 |
–1366,91 |
–2254,21 |
0 |
кДж/моль |
|
|
|
|
Решение. Тепловой эффект реакции определяем по второму следствию из закона Гесса. В соответствии с уравнением реакции
∆rН0298 = (1 ∆cН0ук + 1 ∆cН0эс) – (1 ∆cН0эа + 1 ∆cН0H2O) =
= [1(–873,79) + 1(–1366,91)] – [1(–2254,21) + 1 0] = 13,51 кДж.
5.2.5. Зависимость теплового эффекта реакции от температуры
Если системе, содержащей один моль вещества, сообщить элементарное количество теплоты δQ, то ее температура повысится на бесконечно малую величину dT: δQ = сdT, соответственно
c=δdTQ ; с – молярная теплоемкость вещества, численно равная
количеству теплоты, которое необходимо сообщить одному молю вещества для нагревания его на 1 K. Размерность молярной тепло-
емкости − Дж/моль К.
146

Поскольку δQ зависит от пути процесса, то необходимо указать условия его протекания. Для изохорных и изобарных процессов соответственно различают теплоемкость при постоянном объеме cV (изохорная теплоемкость) и при постоянном давлении cp (изобарная теплоемкость):
cV = δdTQV = dUdT , cр = δdTQр = dHdT .
Чтобы найти изменение внутренней энергии или энтальпии вещества при изменении температуры системы от Т1 до Т2, необходимо интегрировать соответствующее уравнение.
С практической точки зрения большее значение имеют химические процессы, протекающие в изобарных условиях, тепловой эффект которых рассчитывают через изменение энтальпии. Используя справочные значения энтальпий образования веществ, можно рассчитать стандартный тепловой эффект реакции. Чаще всего на практике реакции протекают при температурах, отличных от стандартной. Поэтому для расчета теплового эффекта необходимо учитывать изменение энтальпии при изменении температуры.
Если в интервале от 298 K до температуры Т K нет фазовых переходов, то изменение энтальпии образования вещества составит:
f HT − f H 0 |
T |
298 = ∫cрdT . |
|
|
298 |
Соответственно энтальпия образования вещества при температуре Т:
f HT = f H 0 |
T |
298 + ∫cрdT . |
|
|
298 |
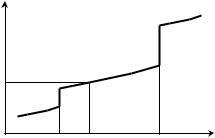
Если в температурном интервале имеются фазовые переходы, то при расчете необходимо учитывать изменение энтальпии вещества при фазовом переходе. При температуре фазового перехода происходит скачкообразное изменение энтальпии и теплоемкости вещества. При переходе от низкотемпературной фазы к высокотемпературной энтальпия увеличивается, а при обратном переходе уменьшается на ту же величину, которая называется энтальпией
фазового перехода. Например, ∆mН0 (кДж/моль) – энтальпия плавления (melting – плавление); ∆vН0 (кДж/моль) – энтальпия испаре-
ния (vaporization – испарение).
147
273 |
|
373 |
T2 |
HT 2 − HT1 = ∫cртdT + mH 0 |
+ ∫ cржdT + v H 0 |
+ ∫cрпdT , |
|
T1 |
|
273 |
373 |
cpi – изобарная теплоемкость каждой фазы. |
|
||
Изменение энтальпии одного моля воды при изобарном нагре- |
|||
вании от Т1 < 0°С, до Т2 > 100°С показано на рис. 5.4. |
|
||
∆fHT |
|
(cp) пар |
|
|
|
|
|
|
|
∆vH0 |
|
(cp) жидкость |
|
||
∆fH0298 |
|
|
|
(cp) лед ∆mH0 |
|
|
|
273 |
298 |
Т, К |
|
373 |
|
||
Рис. 5.4. Зависимость энтальпии образования одного моля воды ∆f HT |
|||
от температуры |
|
||
Часто для небольших температурных интервалов можно считать, что теплоемкость не зависит от температуры. В этом случае,
используя среднее значение молярной теплоемкости cр , измене-
ние энтальпии одного моля вещества можно рассчитать по формуле
∆HТ2 – ∆HТ1 = cр (T2 – T1).
При более точных расчетах необходимо учитывать зависимость изобарной теплоемкости от температуры. В температурной облас-
ти 300 …2000 K экспериментальную зависимость cp от Т аппроксимируют полиномами вида
cp(Т) = а + bТ + cТ2 +… или cp(Т) = а + bТ + c′Т–2.
Все коэффициенты для индивидуальных веществ и температурные области их использования приводятся в справочной литературе.
Таким образом, тепловой эффект реакции при температуре Т по первому следствию из закона Гесса можно определить, учитывая зависимость энтальпии образования i-го вещества от температуры:
148
