
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
Б. Баланс зарядов (суммарный заряд частиц с учетом участвующих электронов до и после реакции должен быть одинаковым):
Cr2O72- + 14 H+ +6 ē → 2 Cr+3 + 7 H2O ×1
SO32- + H2O − 2 ē → SO42- + 2 H+ ×3
3. Баланс электронов. Количество отданных электронов должно быть равно количеству полученных (находят наименьшее общее кратное для количества отданных и полученных электронов и умножают каждую полуреацию на соответствующий сомножитель).
4. Сложение полуреакций с учетом всех коэффициентов: Cr2O72-+14 H++6 ē+3SO32-+3H2O−6 ē → 2Cr+3+7H2O+3SO42-+6 H+.
Сокращение одинаковых частиц до и после реакции: Cr2O72-+8 H++3SO32- → 2 Cr+3+4 H2O+3 SO42-.
5.Расстановка стехиометрических коэффициентов в уравнении реакции.
K2Cr2O7 + 3Na2SO3+8 HNO3 = 2 Cr(NO3)3+3 Na2SO4+2 KNO3+4 H2O.
6.Проверка правильности расстановки коэффициентов по балансу кислорода: 40 O = 40 O.
1.2. Классификация веществ
Простые вещества – это вещества, молекулы (формульные единицы) которых состоят из одинаковых атомов. Название простых веществ, как правило, совпадает с названием элемента. Большинство их являются металлами, формульная единица – атом. Например: медь – Cu; алюминий – Al; цинк – Zn; калий – К. Неметаллы состоят обычно из двухатомных молекул. Например: водород – H2; кислород – O2; йод – I2. Простые вещества могут существовать в виде различных аллотропных модификаций, отличающихся друг от друга либо числом атомов в молекуле, например кислород – O2, озон – O3, либо структурой кристаллов: алмаз, графит.
Сложные вещества состоят из различных атомов. Их условно разделяют на органические и неорганические.
Молекула органических веществ содержит в своем составе обязательно атомы углерода и водорода (СсHh), а также может содержать атомы и других элементов: кислород (СсHhOo), азот, галоген (СсHhOoNnClx) и др. Органические соединения разделяют на:
12
•углеводороды – СсHh (насыщенные, ненасыщенные, циклические, ароматические и др.), R – углеводородный радикал (СсHh-1);
•кислородосодержащие производные углеводородов – СсHhOo
–спирты (R-ОН), альдегиды (R-СН=О), кетоны (R-(С=О)-R), кислоты (R-СООН), простые эфиры (R-O-R), сложные эфиры (R- СОО- R) и др.;
•азотосодержащие производные углеводородов СсHhOoNn – нитросоединения (R-NO2), амины (R-NH2) и др.
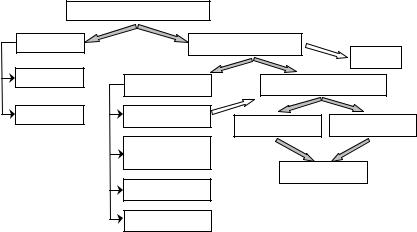
Неорганические вещества – все вещества, не относящиеся к органическим, в том числе и соединения углерода− оксиды, угол ь- ная кислота и соли (карбонаты) и др. (см. рисунок).
Неорганические вещества |
|
|
|
Простые Эx |
Сложные AxByCz… |
… |
|
|
|
|
|
Металлы |
Бинарные AxBy |
Гидроксиды HxЭyOz |
|
|
|||
Неметаллы |
Оксиды AxОy |
Кислоты |
Основания |
|
|
||
|
Галогениды: |
|
|
|
AClx; ABrх; AIx |
|
Соли |
|
|
|
|
|
Сульфиды AxSy |
|
|
|
… |
|
|
Простейшими из неорганических веществ являются бинарные соединения, молекула (формульная единица) которых состоит из атомов двух различных элементов. В формуле на первом месте стоит элемент с положительной степенью окисления, а на втором месте – с отрицательной, как правило, это неметалл. Название состоит из латинского названия второго элемента с суффиксом – «ид» и русского названия первого с указанием при помощи греческих числительных количество соответствующих атомов.
П р и м е р. Na2O – оксид динатрия; SO3 – триоксид серы; H2S – сульфид диводорода Al2S3 − трисульфид диалюминия; HCl – хлорид водорода; CaCl2 – дихлорид кальция.
13
П р и м е ч а н и е. Латинские названия некоторых элементов и их корни, используемые в названиях неорганических веществ:
№ |
|
Название |
Корень |
№ |
|
Название |
Корень |
||
|
|
Русский |
Латинский |
|
|
|
Русский |
Латинский |
|
1 |
H |
Водород |
Hydrogenium |
гидр- |
16 |
S |
Сера |
Sulfur |
сульф- |
4 |
Be |
Бериллий |
Beryllium |
берилл- |
17 |
Cl |
Хлор |
Chlorum |
хлор- |
6 |
C |
Углерод |
Carboneum |
карб- |
24 |
Cr |
Хром |
Chromium |
хром- |
7 |
N |
Азот |
Nitrogenium |
нитр- |
25 |
Mn |
Марганец |
Manganum |
манган- |
8 |
O |
Кислород |
Oxygenium |
окс- |
26 |
Fe |
Железо |
Ferrum |
ферр- |
13 |
Al |
Алюминий |
Aluminium |
алюм- |
29 |
Cu |
Медь |
Cuprum |
купр- |
14 |
Si |
Кремний |
Silicium |
силик- |
30 |
Zn |
Цинк |
Zincum |
цинк- |
15 |
P |
Фосфор |
Phosphorus |
фосф- |
50 |
Sn |
Олово |
Stannum |
станн- |
|
Греческие числительные, используемые как числовые приставки: |
|
|||||||
1 − моно, 2 − ди (би), 3 − три, 4 − тетра, 5 − пента, 6 − гекса, 7 − гепта, 8 − окта, |
|||||||||
поли − неопределенно много. |
|
|
|
|
|
|
|||
|
Соединения элементов с кислородом – оксиды. Практически |
||||||||
все элементы образуют оксиды в результате прямого взаимодействия простого вещества с кислородом (скорость и степень превращения зависит от температуры взаимодействующих веществ). Различают 1) солеобразующие оксиды: основные, кислотные и амфотерные. В результате реакции с кислотами или основаниями они дают соответствующие соли; 2) безразличные (несолеобразующие), которым не соответствуют гидроксиды и соли (CO, N2O, NO, …).
Галогениды водорода (HCl, HBr, HJ) − газы, водные растворы которых кислоты; галогениды металлов – соли галогенводородных кислот.
Сульфид водорода − газ (H2S), водный раствор которого − кислота; сульфиды металлов – соли сероводородной кислоты.
Гидроксиды. Оксиды элементов могут химически взаимодействовать с оксидом водорода (вода), при этом реакция протекает без изменения степени окисления элементов. Возможно присоединение к оксиду одной или нескольких молекул воды с образованием одной или двух молекул гидроксида. Реакция гидратации оксида протекает, если гидроксид растворим в воде. Нерастворимые гидроксиды получают косвенным методом, обменной реакцией из солей. В этом случае реакция гидратации может быть написана формально.
Получение гидроксидов: а) гидратация оксидов
CaO + H2O→Ca(OH)2, SO3 + H2O→ H2SO4,
14
N2O3+H2O→2HNO2, P2O5+2H2O→2H3PO4;
б) нерастворимые гидроксиды
Al2O3 (+H2O)→2Al(OH)3, Al3++3OH-→Al(OH)3, SiO2 (+H2O)→H2SiO3, SiO32-+2H+→H2SiO3.
Реакция гидратации обратима, при относительно высоких температурах (специфических для каждого гидроксида) равновесие сдвинуто в сторону исходных веществ, т.е. при высоких температурах протекает реакция дегидратации (способ получения оксидов).
Различное написание формулы гидроксидов связано с написанием рациональных формул (в них выделяют группы атомов, характерные для данного класса соединений). Гидроксиды при рас-
творении в воде подвергаются электролитической диссоциации.
При растворении в воде под действием молекул растворителя растворенное вещество может частично или полностью распадаться на ионы: катионы, заряженные положительно, и анионы, заряженные отрицательно: АВ ↔ А+ + В–.
Отношение (доля) числа распавшихся при диссоциации частиц (Nд) к общему их числу ( Nо) до распада называется степенью дис-
социации α= |
NА+ |
= |
NВ− |
(0<α<1). Вещества, распадающиеся при |
|
Nо |
|
Nо |
|
растворении на ионы, называются электролитами. Считается что, если α→1, то растворенное вещество находится в растворе в виде ионов – сильный электролит. При составлении ионных уравнений его записывают как сумму ионов. Еслиα→0, то растворенное в е- щество находится в растворе в виде молекул – слабый электролит. При составлении ионных уравнений его записывают в виде молекулы.
П р и м е р. Раствор дигидроксида бария (сильный электролит) реагирует с раствором азотной кислоты (сильный электролит), продукты – растворимая соль нитрат бария (сильный электролит) и вода (слабый электролит).
Молекулярное уравнение:
Ba(OH)2 + 2 HNO3 = Ba(NO3)2 + 2 H2O.
Полное ионное:
Ba2++2 OH-+2 H++2 NO3- = Ba2++2 NO3- + 2 H2O.
15
Краткое ионное:
OH- + H+ = H2O.
В молекуле гидроксида атом элемента связан с атомом кислорода, который в свою очередь связан с атомом водорода (Э-О-Н). В зависимости от того, какая связь (О-Н или Э-О) рвется при взаимодействии с молекулами воды и какие ионы образуются в результате электролитической диссоциации, гидроксиды подразделяют на кислотные, основные и амфотерные.
Кислотные гидроксиды (оксокислоты). В молекуле менее прочная связь О-Н, поэтому в результате диссоциации образуются катион водорода (Н+) и анион кислотного остатка (ЭО-) Э-О-Н ↔ Н+ + ЭО-. Оксокислоты образуют неметаллы независимо от степени окисления и металлы с большими степенями окисления (+5, +6, +7). Число атомов водорода в молекуле кислоты называется основ-
ностью кислоты.
Водные растворы водородных соединений некоторых элементов неметаллов подвергаются диссоциации по кислотному типу (бескислородные кислоты). Например, галоген водороды (HCl, HBr, HJ) и сероводород (H2S). Их водные растворы являются кислотами.
П р и м е р. Одноосновные:
HNO3↔ H++ NO3-; HCl ↔ H++ Cl-;
двухосновные:
H2SO4↔2 H++ SO42-; H2S↔ H++ HS-; HS-↔ H++ S2-;
трехосновные:
H3PO4↔H++ H2PO4-; H2PO4-↔H++HPO42-; HPO42-↔H++PO43-.
Систематическое название оксокислот состоит из названия катиона – водород и аниона – название числа атомов кислорода (-оксо) и элемента с суффиксом «ат», в скобках римской цифрой указывается степень окисления элемента. Например, H2SO4 – тетраоксосульфат (VI) водорода; HNO3 – триоксонитрат (V) водорода; HNO2 – диоксонитрат (III) водорода.
Чаще используется традиционное название, состоящее из прилагательного, образованного от названия элемента с суффиксом «н» или «в» (при высшей степени окисления) и с суффиксом «ист»
16
(при промежуточной степени окисления +3, +4), и слова «кислота». Например:
Формула |
Название |
Электролит |
Формула |
Название |
Электролит |
H2SO4 |
Серная |
Сильный |
H3PO4 |
Фосфорная |
Средний |
H2SO3 |
Сернистая |
Слабый |
H2CO3 |
Угольная |
Слабый |
HNO3 |
Азотная |
Сильный |
H2Cr2O4 |
Дихромовая |
Сильный |
HNO2 |
Азотистая |
Слабый |
HMnO4 |
Марганцевая |
Сильный |
Водные растворы галогенводородов (сильные электролиты): HCl – хлористоводородная кислота (соляная); HI – йодистоводородная кислота; сероводорода (слабый электролит) H2S – сероводородная кислота.
Основные гидроксиды (основания). В молекуле гидроксидов такого типа менее прочной является связь Э-О. В результате диссоциации образуются катион элемента (Э+) и гидроксо-анион (ОН-) Э-О-Н↔Э+ + ОН-. Основные гидроксиды образуют металлы с небольшой степенью окисления (+1, +2). Число гидроксоионов в молекуле основания называется его кислотностью. Название состоит из названия металла и слова «гидрооксид», если необходимо, с указанием числа гидроксо-ионов или степени окисления металла. Например, NaOH − гидроксид натрия, Fe(OH)2 − дигидроксид железа или гидроксид железа (II), тригидроксид железа Fe(OH)3 или гидроксид железа (III).
Растворимые в воде основания называются щелочами. Их вод-
ные растворы являются сильными электролитами: NaOH ↔ Na++OH-, Ba(OH)2 ↔ Ba2++2 OH-.
Амфотерные гидроксиды. В молекуле таких гидроксидов прочность связей О-Н и Э-О сравнима по величине. В зависимости от условий проведения химических реакций амфотерные гидроксиды могут проявлять свойства как основания, так и кислоты. Обычно это гидроксиды металлов со степенями окисления +2, +3, +4.
П р и м е р. Дигидроксид цинка − Zn(OH)2:
основной тип диссоциации
Zn(OH)2 ↔ Zn 2++2 OH-;
кислотный тип диссоциации
Zn(OH)2 ↔ 2 H++ ZnO22-.
Обменная реакция между гидроксидами, имеющими кислотные (кислоты, амфотерные гидроксиды) и основные свойства (основания, амфотерные гидроксиды), называется реакцией нейтрализации.
17
Условием ее протекания является образование слабого электролита или осадка. В реакции нейтрализации таким веществом является вода, которая образуется ионами водорода (Н+) кислоты и гидроксоионов (ОН-) основания: Н++ ОН- ↔ Н2О.
В растворе остаются ионы, не принимавшие участие в обменной реакции, катион от основания (катион металла) и анион от кислоты (кислотный остаток). При выпаривании можно выделить вещество, относящееся к новому классу неорганических соединений, – соль. Соль можно представить, как продукты замещения атомов водорода кислоты на ион металла или групп ОН- основания на ион кислотного остатка. Соль может непосредственно образовываться и при проведении реакции нейтрализации, если она нерастворима.
Систематическое название солей подобно названию кислот. Например, K2SO4 − тетраоксосульфат (VI) калия; NaNO3 – триоксонитрат (V) натрия; NaNO2 – диоксонитрат (III) натрия; K2Cr2O7 − гептаоксосульфат (VI) калия.
Традиционное название состоит из прилагательного, образованного латинским названия элемента с суффиксом «ат» (при высшей степени окисления элемента) и с суффиксом «ит» (при промежуточной степени окисления +3, +4) и русского названия катиона, например:
Формула |
|
Название |
Формула |
Название |
K2SO4 |
|
Сульфат калия |
Ca3(PO4)2 |
Фосфат кальция |
Na2SO3 |
|
Сульфит натрия |
MgCO3 |
Карбонат магния |
Pb(NO3)2 |
|
Нитрат свинца |
Na2ZnO2 |
Цинкат натрия |
NaNO2 |
р |
Нитрит натрия |
Na2PbO2 |
Плюмбит натрия |
П р и м е |
1. Взаимодействие растворимых кислот и основа- |
|||
ний:
Н2SO4+ 2KОН → K2SO4+2Н2О, 2 Н++ 2 ОН- → 2 Н2О;
Н2SO4+Ba(OH)2→BaSO4↓+2Н2О;
2Н++SO42-+Ba2++2ОН-→BaSO4↓+2Н2О.
П р и м е р 2. Взаимодействие нерастворимых оснований и ки-
слот:
Ni(OH)2+2HNO3→ Ni(NO3)2+2Н2О, Ni(OH)2+2H+→ Ni2++2Н2О; Ni(OH)2 + Н3PO4 → реакция невозможна, поскольку Ni3(PO4)2 − фосфат никеля − нерастворим.
Амфотерные гидроксиды могут вступать в реакцию нейтрализации как с кислотой, реализуя основные свойства, так и с основанием, проявляя кислотные свойства. В обоих случаях продуктами
18
будут соль и вода. В первом случае металл, образующий гидроксид, в составе соли будет катионом, а во втором входит в состав оксоаниона. Например, амфотерный дигидроксид цинка Zn(OH)2:
основные свойства
Zn(OH)2 + 2HCl ↔ ZnCl2+2H2O, Zn(OH)2 + 2H+↔ Zn 2++2H2O;
кислотные свойства
Zn(OH)2 + 2KОН ↔ K2ZnO2+2H2O, Zn(OH)2+2ОН-↔ZnO22-+2H2O.
Солеобразующие оксиды (основные, кислотные, амфотерные) реагируют с кислотами и основаниями с образованием солей, подобно их гидроксидам.
П р и м е р: основной оксид
MgO + 2 HNO3→ Mg(NO3)2+Н2О, (MgO→Mg(OH)2); |
|
кислотный оксид |
|
CO2 + Ca(OH)2→ CaCO3 + Н2О, (CO2→ H2CO3); |
|
амфотерный оксид |
|
ZnO + 2HCl ↔ ZnCl2+2 H2O, |
(ZnO→Zn(OH)2); |
ZnO + 2KОН ↔ K2ZnO2+H2O, |
(ZnO→Zn(OH)2). |
Соль образуется замещением атомов водорода кислоты на ион металла или групп ОН- основания на ион кислотного остатка.
В случае многоосновных кислот возможно как полное замещение ионов H+ с образованием средних солей, так и неполное замещение с образованием кислых солей. В название кислой соли включают приставку «гидро». Кислые соли получаются в реакции нейтрализации при недостатке соответствующего основания, либо добавлением к средней соли кислоты.
Пример. Сульфит (Na2SO3) и гидросульфит ( NaHSO3) натрия:
2NaOH + H2SO3 → Na2SO3 + 2H2O, 2OH- + H2SO3 → SO32- + 2H2O; NaOH + H2SO3 → NaHSO3 + H2O, OH- + H2SO3 → HSO3- + H2O; Na2SO3+ H2SO3→ 2 NaHSO3, SO32-+ H2SO3→ 2 HSO3-.
В основании, содержащем несколько ионов ОН-, возможно их полное замещение с образованием средней соли, так и неполное с образованием основных солей. Эти соли получаются в реакции нейтрализации при недостатке кислоты либо добавлением к средней соли основания. В название основной соли включают приставку «гидроксо».
19
