
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список
Ферми (в валентной зоне) одинаково. Их распределение по энергии зеркально симметрично (рис. 4.12).
В кристаллах, имеющих небольшую ширину запрещенной зоны, возможен переход электронов из валентной зоны в зону проводимости вследствие их теплового возбуждения, с образованием в валентной зоне свободного энергетического состояния (уровня), получившего название «дырка» (рис. 4.13).
p
1 |
|
0 oK |
|
|
|
зона проводимости |
|
|
EC |
|
ē |
||||
|
T>0 oK |
|
|||||
|
|
|
|
||||
|
|
|
|
Eg |
|||
|
|
|
|
EF |
|
|
|
0 |
|
|
E |
EV |
|
p+ |
валентная зона |
|
|
|
|||||
|
|
||||||
|
EF |
|
|
|
|||
Рис. 4.12. Распределение электронов по |
|
Рис. 4.13. Образование в кристалле |
|||||
энергетическим состояниям для метал- |
|
электронно-дырочных пар: ē − элек- |
|||||
|
лов |
|
трон проводимости; p+ − дырка |
||||
Вероятность этого перехода зависит от ширины запрещенной зоны (Eg) и температуры. При относительно высоких температурах
(E – EF)>>kT, exp E −EF >>1, функция распределения приобре-
kT
|
|
E −E |
F |
|
|
тает вид p=exp |
− |
|
|
. Так как уровень Ферми находится в |
|
kT |
|
||||
|
|
|
|
|
середине запрещенной зоны: EF =EC −0,5 Eg , то для E = EC →
→ E −kTEF = 2EkTg . Таким образом, вероятность перехода электро-
нов из валентной зоны в зону проводимости будет определять функция
|
|
E |
g |
|
|
− |
|
|
|
|
|
|||
p=exp |
|
|
. |
|
|
|
2kT |
||
4.2.7.Металлы, полупроводники и диэлектрики
Взависимости от ширины запрещенной зоны (Eg) все твердые тела подразделяются на металлы (Eg < 0,08 эВ), диэлектрики (Eg > 3 эВ), полупроводники (0,08 эВ < Eg < 3 эВ).
117
Металл – кристалл, в котором либо имеется зона проводимости, в которой не все энергетические уровни заняты электронами, либо зона проводимости и валентная зона перекрываются. Ширина запрещенной зоны равна нулю, или ее величина меньше тепловой энергии кристалла, которая составляет величину порядка 3kT, что при T=300 К примерно равно 0,08 эВ. В металлах число свободных электронов сравнимо с числом атомов в том же объеме
( 1022 атом/см3), при этом концентрация электронов не зависит от
температуры. Электропроводность при T≈300K велика. Металлами являются кристаллические вещества с металлическим типом химической связи.
У диэлектрика и полупроводника ширина запрещенной зоны больше, чем энергия тепловых колебаний решетки. Если эта ширина не слишком велика, то существует вероятность перехода электронов из валентной зоны в зону проводимости за счет тепловых колебаний решетки либо за счет поглощения кванта света. Условной границей подразделения кристаллов на полупроводники и диэлектрики является ширина запрещенной зоны, при которой возможен переход электрона из валентной зоны в зону проводимости при поглощении кванта видимого света. Энергия кванта, соответствующего коротковолновой границе видимой области света
(λ 400 нм), составляет величину hν ~ 3 эВ.
Полупроводник – кристалл, у которого все энергетические уровни валентной зоны при T = 0 K заняты, а ширина запрещенной зоны находится в интервале 0,08 эВ <Eg<3 эВ. Концентрация свободных электронов при Т = 0 K равна нулю, с ростом температуры она экспоненциально растет (увеличивается вероятность перехода электронов из валентной зоны в зону проводимости), соответственно экспоненциально растет и электропроводность:
|
|
E |
g |
|
|
− |
|
|
|
|
|
|||
σ(Т) exp |
|
|
. |
|
|
|
2kT |
||
В полупроводниковых кристаллических веществах химическая связь относится к ковалентному или смешанному ионноковалентному типу.
Диэлектрик – кристалл, имеющий ширину запрещенной зоны много больше, чем энергия тепловых колебаний (Е>>kT), концентрация свободных электронов равна нулю. Электропроводность незначительна, слабо зависит от температуры. Как правило, это
118
молекулярные кристаллы и вещества с ионным или ионковалентным типом химической связи.
П р и м е р 1. Металлический кристалл Li. Валентные электроны 2s1. 2s-атомные орбитали образуют зону, которая заполнена только наполовину.

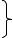 2s- зона проводимости
2s- зона проводимости
П р и м е р 2. Металлический кристалл Mg. Валентные электроны 3s2. Валентная зона магния заполнена электронами полностью, свободные уровни, которые могли бы обеспечить перемещение электронов в валентной зоне, отсутствуют. Ближайшая по энергии зона, зона проводимости, образованная свободными 3p- атомными орбиталями, перекрывается с валентной зоной.
3p-зона проводимости
3s-валентная зона
П р и м е р 3. Кристалл Si. Валентные электроны 3s23p2. Кремний – ковалентный кристалл, связи осуществляются электронами, располагающимися на sp3-гибридных орбиталях, которые образуют как валентную зону, так и зону проводимости. Каждый атом кремния имеет 4 sp3-гибридные орбитали, т.е. в кристалле, состоящем из N атомов, имеется 8N энергетических состояний электронов. Нижняя по энергии половина из них при Т = 0 K полностью заселена, образуя валентную зону, а верхняя свободна, образуя зону проводимости. В отличие от магния в кристалле кремния валентная зона и зона проводимости не перекрываются. Ширина запрещенной зоны Eg=1,12 эВ. Кристалл кремния – полупроводник.
sp3 зона проводимости
Eg 
sp3 валентная зона
П р и м е р 4. Кристалл NaCl. Химическая связь относится к ионному типу. Валентную зону образуют заполненные орбитали
119
Cl- – 3s23p6, а зону проводимости − свободные орбитали Na+ – 3s0. В кристалле хлорида натрия, так же как и в случае с кристаллом кремния, валентная зона и зона проводимости не перекрываются. Но ширина запрещенной зоны много больше, чем у кремния, Eg = = 7,7 эВ, хлорид натрия – диэлектрик.
4.2.8. Кристаллические материалы
Наиболее близким к идеальному понятию «кристалл» является монокристаллический материал. Монокристалл («монос» – один)
– твердое вещество с непрерывной кристаллической решеткой во всем объеме физического тела. Линейные размеры монокристаллов могут составлять доли микрометра и доходить до 1 м. Монокристаллы, в силу своего внутреннего строения, обладают анизотропными свойствами. Анизотропия («анизос» – неравный, «тропос» – направление) – зависимость физических и физикохимических свойств тела от направления в кристалле. Если в рассматриваемом физическом теле имеется несколько различным образом ориентированных, связанных между собой сильными химическими связями монокристаллов, то данное тело представляет собою блочный монокристалл. Границы отдельных блоков (монокристаллов) – дефекты кристаллической структуры.
Гораздо более распространены в природе твердые тела, состоящие из большого числа произвольно ориентированных относительно друг друга мелких монокристаллов, сцепленных как сильными, так и слабыми химическими связями. Такие тела называются поликристаллами («полис» – многочисленный). Поликристаллические тела, вследствие усреднения анизотропных свойств отдельных произвольно ориентированных монокристаллов, обладают изотропией физических и физико-химических свойств.
Дефекты кристаллической решетки. Если структура твердо-
го тела соответствует идеальной кристаллической решетке, то система находится в состоянии с минимумом энергии. Это соответствует состоянию идеального кристалла при Т = 0 K. Любое сообщение системе дополнительного количества энергии переводит ее в возбужденное состояние, при этом в кристалле нарушается строгая периодичность расположения частиц в кристаллической решетке, т.е. создаются дефекты.
120
Другим типом дефектов являются нарушения регулярности решетки, связанные с примесями, которые появились в кристалле случайно (химические примеси) или были введены в него преднамеренно (легирующие добавки). С дефектами связаны многие физические и химические свойства кристаллов (электропроводность, прочность, оптические свойства, коррозионная стойкость и др.).
Различают точечные дефекты, линейные (дислокации) и двумерные (поверхности, границы кристаллических зерен), объемные (пузыри). Дефекты возникают как в процессе кристаллизации, так и в результате внешних воздействий на кристалл. Создание дефектов связано с разрывом имеющихся химических связей между атомами кристалла или образованием дополнительных связей.
Простейшими из точечных дефектов в полупроводниках явля-
ются электроны проводимости и дырки. Электронно-дырочная пара образуются в результате асимметричного разрыва химической связи между атомами кристалла при поглощении тепловой энергии. При этом один из атомов приобретает избыточный отрицательный заряд за счет дополнительного валентного электрона (электрон проводимости), а другой – избыточный положительный (дырка). Оба дефекта могут перемещаться по кристаллу независимо друг от друга. Электрон проводимости перемещается путем эстафетной передачи избыточного электрона от атома к атому, а дырка – путем эстафетного захвата электрона от атома к атому.
В процессе образования электронно-дырочных пар большую роль играют примесные атомы, находящиеся в узлах кристаллической решетки. Атомы примеси, имеющие число валентных электронов большее, чем число связей с ближайшими соседями (элек- тронно-избыточные примеси), являются источником электронов проводимости. Образующиеся при этом дырки локализованы на примесном атоме и не могут мигрировать по кристаллу. Атомы примеси, имеющие число валентных электронов меньше, чем число связей с ближайшими соседями (электронно-дефицитные примеси), являются источником дырок, а электрон будет локализован на атоме примеси.
Энергия, необходимая для образования электронно-дырочных пар, может быть сообщена кристаллу не только нагреванием, но и при поглощении электромагнитного излучения. Причем энергия кванта электромагнитного излучения должна быть больше, чем ширина запрещенной зоны (энергии ионизации химической связи).
121
Необходимо отметить, что в кристаллах диэлектриков элек- тронно-дырочные пары не образуются при подводе тепловой энергии из-за большой величины ширины запрещенной зоны. Они могут быть образованы при поглощении электромагнитного излучения достаточной энергии или ионизирующего излучения.
В кристаллах могут быть дефекты, образованные без разрыва химической связи, например экситоны (от лат. excito – возбуждаю) – квазичастицы, представляющие собою возбужденные состояния атомов кристаллической решетки. Возбуждения могут передаваться от атома к атому, мигрируя по кристаллу.
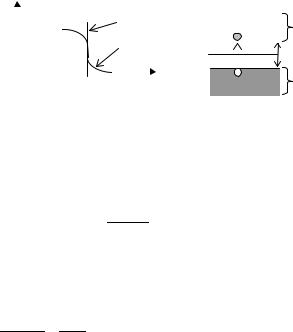
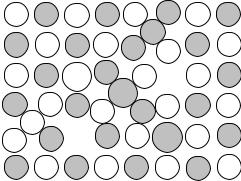
Точечные дефекты, связанные с нарушением регулярности расположения частиц в кристалле, могут быть собственными – разупорядочение решетки, и примесными – присутствие в кристалле посторонних атомов (рис. 4.14).
A+G
B-I
B-G
P+G |
Va |
|
PI |
A+I |
P-G |
Vc |
Рис. 4.14. Точечные дефекты в решетке ионного кристалла: A+G – катионы в узлах решетки; B-G − анионы в узлах решетки; вакансии: Vc – катионные; Va – анионные; межузельные ионы: A+I – катион; B-I − анион; примесные ионы в узле решетки: катион (P+G) или анион (P-G); примесный атом или ион в межузельном положении (PI)
Собственные дефекты – вакансия – отсутствие в узле решетки частицы, образующей кристалл; межузельные атомы или ионы.
В ионных кристаллах отсутствие в узле решетки катиона или аниона (катионные и анионные вакансии) нарушает баланс электрических зарядов. Поэтому в кристалле должно быть либо равное количество катионных и анионных вакансий (дефекты Шоттки), либо на каждую ионную вакансию необходимо равное количество межузельных частиц того же знака (дефекты Френкеля).
122

Собственные дефекты образуются в кристалле в результате теплового движения частиц при температурах выше 0 K. Для создания собственного дефекта частица должна перейти из узла решетки в междоузлие. Для этого ей необходимо преодолеть потенциальный барьер, который называется энергией образования дефекта (Ед). Вероятность преодоления потенциального барьера и образования дефекта определяется количеством частиц, имеющих энергию большую, чем Ед. Из молекулярно-кинетической теории известно, что доля таких частиц зависит от температуры и пропор-
циональна множителю exp − Eд . Таким образом, каждой темпе-
kT
ратуре соответствует равновесная концентрация собственных дефектов (n), которая экспоненциально увеличивается с ростом температуры:
n≈Aexp − Eд ,kT
где А – предэкспоненциальный множитель, k – константа Больцмана; T – температура, K.
Точечные примесные дефекты связаны с присутствием в твердом веществе химических примесей. Примесный атом или ион может находиться в узле решетки или в межузельном положении. Где будет находиться примесная частица, как правило, зависит от соотношения ее размеров и размеров частиц, образующих решетку.
Точечные дефекты вызывают нарушение регулярного расположения частиц кристалла в их ближайшем окружении (искажение кристаллической решетки), тем самым увеличивая энергию кристаллической решетки (рис. 4.15).
Дефекты могут захватывать электрон или отдавать его (захватывать дырки), могут взаимодействовать друг с другом, образовывая более сложные структуры (ассоциаты). Например, в щелочногалоидных кристаллах (А+В-) анионная вакансия может захватить электрон Vaē (электрон располагается на орбиталях катионов, окружающих анионную вакансию) и образуется так называемый F-центр. Если межузельный анион отдает электрон (захватывает дырку), то образуется H-центр (В0), который может с ближайшим решеточным анионом образовать молекулярный ион В2- (Vк-центр).
123
ē
p+
ex0
PG |
PI |
I |
V |
Рис. 4.15. Искажение кристаллической решетки точечными дефектами. Электронные возбуждения: электроны (e-) A+ē→A-, дырки (p+) A-ē→A+, экситоны (ex0) A*. Собственные точечные дефекты: вакансии (V), межузельные атомы (I) Примесный точечный дефект: решеточный примесный атом (PG), межузельный примесный атом (PI)
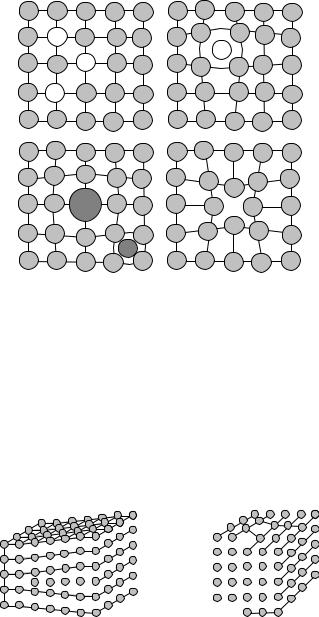
Линейные дефекты кристаллической решетки – дислокации – дефекты, представляющие собой линии, вдоль которых нарушено правильное чередование атомных плоскостей. Дислокации появляются в кристалле в результате пластической деформации или в процессе роста кристалла. Простейшими типами дислокаций являются краевые и винтовые дислокации (рис. 4.16).
а) |
б) |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 4.16. Краевая (а) и винтовая (б) дислокации
124
