
- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
2.4 Хімічні процеси при горінні водню
Взаємодія
молекули водню з молекулою кисню протікає
складною шляхом через ряд послідовних
стадій. В даний час твердо встановлено,
що горіння водню відбувається по
ланцюговому механізму, причому роль
активних центрів грають частинки
![]() . Послідовність і значення елементарних
реакцій при горінні водню описані дуже
детально для різних умов виникнення і
розвитку водневих пламен.
. Послідовність і значення елементарних
реакцій при горінні водню описані дуже
детально для різних умов виникнення і
розвитку водневих пламен.
Найбільш докладний аналіз процесу горіння водню в режимі самозаймання експериментальним і розрахунковим методами виконаний професором А. Н. Баратовим. Їм запропонована наступна схема процесу, що включає чотирнадцять основних елементарних реакцій:
- зародження активних центрів відбувається по реакції
![]()
- продовження ланцюгів по реакціях
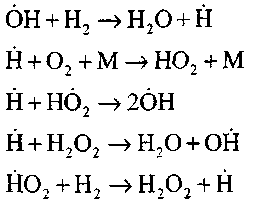
- розгалуження ланцюгів
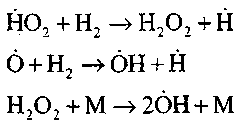
- обрив ланцюгів

Концентрація атомів водню в початковій стадії процесу самозаймання складає незначну частину від початкового змісту водню. При розвитку ланцюгової реакції швидкість перетворення молекулярного водню стає такою високою, що він витрачається за соті долі секунди.
2.3. Хімічні реакції при горінні оксиду вуглецю
Взаємодія оксиду вуглецю з киснем є найважливішою для процесів горіння реакцією. Протікання цієї реакції у багатьох випадках визначає закономірності горіння углеродсодержащих речовин. Для реакції характерний розгалужений ланцюговий механізм. Вона відрізняється поряд особливостей.
Тривалий час існувало переконання, що абсолютно суха суміш З і 02 не може запалати і горіти. Проте ретельно поставлені досліди, в яких відсутність води контролювалася за допомогою масс-спектрографа, показали, що займання можливе і для сухої суміші. При цьому слід зазначити, що присутність в системі СО + 02 пари води або водню активізує процес займання і горіння за рахунок збільшення кількості можливих активних центрів. Прискорююча дія води особлива помітно при малих її концентраціях.
Горіння оксиду вуглецю у присутності пари води або невеликих добавок водню відбувається за участю наступних елементарних процесів:
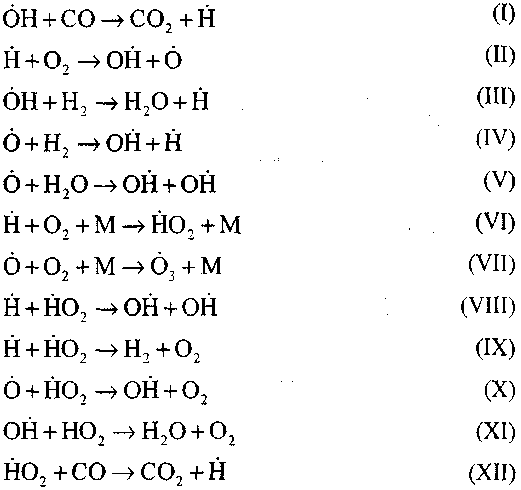
Радикали, Н02, що утворюються по реакції (VI), можуть продовжувати ланцюг (реакція VIII) або приводити до її обриву по реакція (IX-XII).
Для оцінки умови переходу повільного окислення СО в ланцюговий вибух оцінимо вірогідність обриву ланцюга через радикала Н02; при цьому врахуємо, що роль реакцій (X) і (XI) в обриві ланцюга буде неістотною в порівнянні з реакцією (IX), оскільки константи швидкостей процесів (IX-XI) при температурах порядку 1000 К близькі між собою, але концентрації радикалів і значно менше концентрації атомів водню, оскільки радикали і володіють більшою хімічною активністю. Тому вірогідність обриву ланцюга через радикала Н02 може бути записана у вигляді:
![]()
де![]() -
константи швидкостей відповідних
реакцій.
-
константи швидкостей відповідних
реакцій.
ЛЕКЦІЯ 3. МАТЕРІАЛЬНИЙ І ТЕПЛОВИЙ БАЛАНС ПРОЦЕСІВ ГОРІННЯ
Питання для розгляду на лекції:
3.1 Визначення матеріального балансу.
3.2 Витрата повітря на горіння.
3.3 Продукти горіння. Дим та його властивості.
3.4 Горіння газу індивідуального складу.
3.5 Горіння індивідуальних речовин в конденсованому стані.
3.6 Тепловий ефект хімічної реакції.
3.7 Теплота згоряння. Види теплоти згоряння.
3.8 Поняття та види температури горіння речовин.
