
- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
5.2 Теплова теорія само спалахування
Якісні уяви Вант-Гоффа про запалення, як термічний саморозгін реакції, отримали кількісне тлумачення в теорії Семенова теплового вибуху. Ця теорія стала основою для подальшого розвитку фізико-хімічної теорії самоспалахування. Як вже було сказано, горіння виникне в тому випадку, коли кількість тепла, що виділяється в системі, перевищить кількість тепла, що відводиться з системи.
Теорія виходить з визначення критичних умов виникнення горіння, як рівності швидкості тепловиділення від хімічної реакції та швидкості тепловіддачі від газу, що реагує в середині судини, до стінок, які нагріті до температури запалення.
Аналітично інтенсивність процесу тепловиділення в фронті полум’я в залежності від виду пального, його концентрації та температури виражається рівнянням:
q (+) =Qн Vгсφ гвφ ок exp (-Eакт/RT)
Де Eакт - енергія активації системи, кДж/моль;
R-універсальна газова стала, кДж/(моль К);
T-температура суміші, що реагує, К.
Qн - теплота згоряння речовини, кДж/моль;
Vгс - обсяг горючої суміші (судини).
При відносно високих температурах відбувається поступове зниження концентрації реагентів внаслідок їхнього швидкого окислення. За рахунок цього швидкість хімічної реакції, а, отже, і інтенсивність тепловиділення при цих температурах прямує не до нескінченності, як витікає з рівняння, а асимптотично наближається до деякого максимального значення. Тому функція q(+) = f(T) має точку перегину.
Зміна q(+) з температурою при різноманітних початкових значеннях тиску показана на рис. 5.3 серією кривих 1, 2, 3.
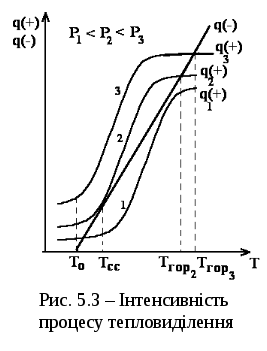
Рис. 5.3
Тепло, що виділяється в ході реакції окислення, буде витрачатися на нагрів суміші і відповідно на підвищення швидкості реакції. Як тільки температура пальної газової суміші всередині судини підвищиться за рахунок накопичення в ній тепла і стане вище температури стінок судини, виникає тепловий потік в довкілля. Якщо теплопередача від газу з температурою Т здійснюється до стінок судини з поверхнею S і температурою Т0 тільки за рахунок теплопровідності (тобто при відсутності конвекційних потоків і турбулентного переносу тепла), то швидкість віддання тепла не залежить від тиску, і її зміни з температурою визначається з рівняння Ньютона:
q(–) = А S (Т — Т0)
де Т - температура газової суміші;
Т0 - температура стінок судини;
S - площа поверхні стінок судини.
α - коефіцієнт тепловіддачі.
Графічно інтенсивність тепловіддачі можна представити прямою, що проходить через точку (То, 0). При Р1 (крива 1) швидкість тепловиділення спочатку перевищує швидкість тепловідводу, що наводить до деякого розігріву газу від Т0 до Т1. Але при більш високих температурах швидкість тепловідводу перевищує швидкість тепловиділення від реакції, тому подальше підвищення температури газу припиниться. Збільшення швидкості реакції в цих умовах виявляється неможливим.
Навпаки, при значно більш високому початковому тиску P3 (крива 3) швидкість тепловиділення завжди буде перевищувати швидкість тепловіддачі, що призведе до прогресивного розігріву газу і збільшенню швидкості тепловиділення аж до запалення.
Між P1 і Р3 є такий тиск, при якому пряма тепловіддачі дотикається кривої тепловиділення (крива 2). Це мінімальний тиск при даній початковій температурі газу, при якому швидкість тепловиділення дорівнює швидкості тепловідводу, і реакція обов’язково переходить в вибух.
Можна, навпаки, поступово підвищувати початкову температуру газу (тобто температуру стінок судини То), при незмінному тиску Р (рис. 5.4). Тоді зміни швидкості тепловідводу при різних початкових температурах буде представлено серією прямих (1, 2, 3) однакового нахилу, відповідного незмінному значенню коефіцієнту тепловіддачі .
При відносно низькій температурі стінок Т0 швидкість тепловідводу після нагріву газу до температури стінок перевищує швидкість тепловиділення від реакції, і подальший розігрів газу і запалення неможливі.
При значно більш високій температурі стінок швидкість тепловідводу різко знижена так, що швидкість тепловиділення перевищує швидкість тепловідводу, це призводить до прогресивного розігріву газу і займання. Деяке проміжне значення температури стінок відповідає такій швидкості тепловіддачі, коли пряма тепловідводу торкається кривої тепловиділення. Це значення температури відповідає мінімальній температурі виникнення горіння при даному тиску Ро.

Рис. 5.4
Змінити співвідношення між тепловиділенням при заданому тиску в системі і тепловіддачею можна змінюючи не тільки початкову температуру стінок судини, але й при зміні коефіцієнту тепловіддачі α (рис. 5.5).
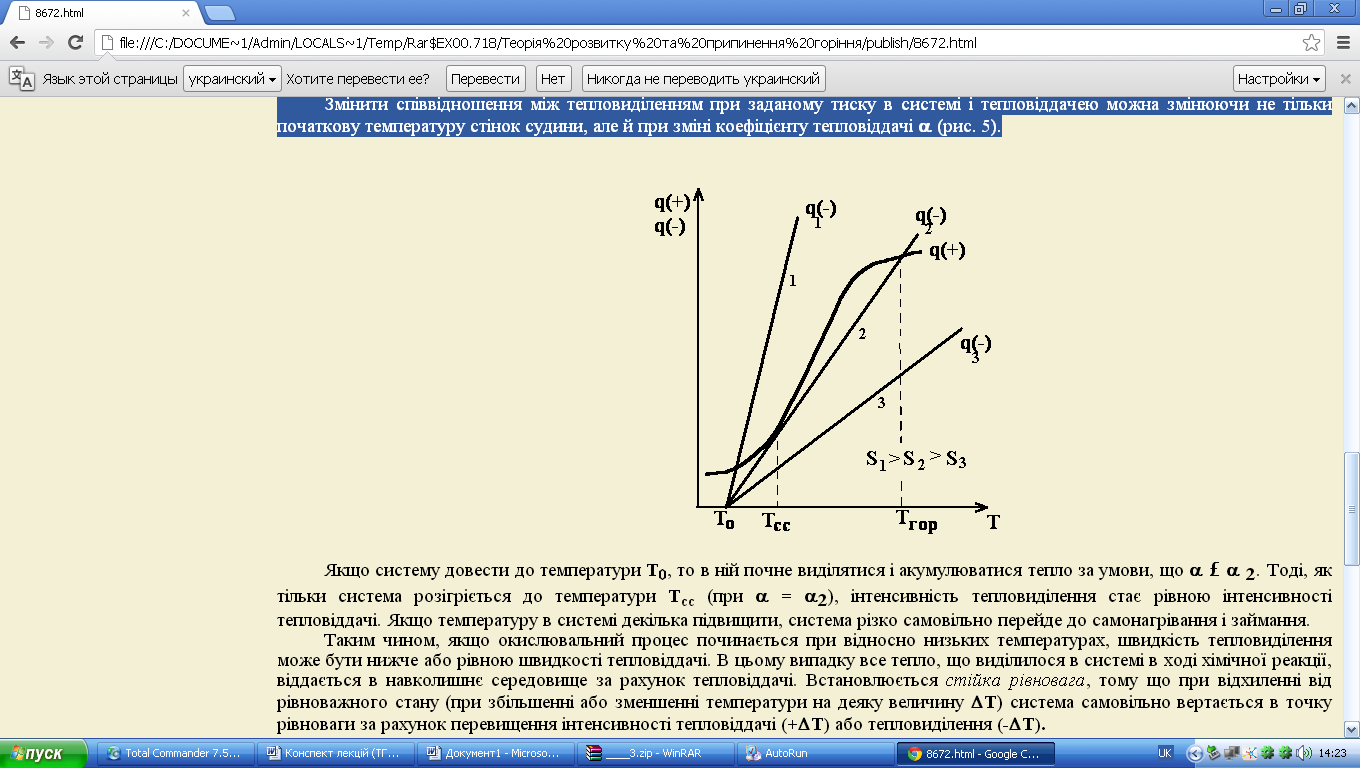
Рис. 5.5
Якщо систему довести до температури Т0, то в ній почне виділятися і акумулюватися тепло за умови, що α ≤ α 2. Тоді, як тільки система розігріється до температури Тсс (при α = α2), інтенсивність тепловиділення стає рівною інтенсивності тепловіддачі. Якщо температуру в системі декілька підвищити, система різко самовільно перейде до самонагрівання і займання.
Таким чином, якщо окислювальний процес починається при відносно низьких температурах, швидкість тепловиділення може бути нижче або рівною швидкості тепловіддачі. В цьому випадку все тепло, що виділилося в системі в ході хімічної реакції, віддається в навколишнє середовище за рахунок тепловіддачі. Встановлюється стійка рівновага, тому що при відхиленні від рівноважного стану (при збільшенні або зменшенні температури на деяку величину Т) система самовільно вертається в точку рівноваги за рахунок перевищення інтенсивності тепловіддачі (+ΔТ) або тепловиділення (-ΔТ) (рис. 5.6).

Рис. 5.6
Точці дотику відповідають критичні умови займання системи при температурі Тсс. Аналізуючи стан системи в точці дотику методом малих змін, переконуємось, що система знаходиться в нестійкій рівновазі, і незначне підвищення температури на величину ΔТ призводить до порушення теплового балансу (перевищення інтенсивності тепловиділення над інтенсивністю тепловіддачі) і переходу системи в точку стійкої рівноваги в області високих температур, тобто при температурі горіння.
Співвідношення між граничними мінімальними значеннями тиску та температури, при яких можливо займання горючої системи, визначається умовою дотику кривої швидкості тепловиділення від реакції з прямою швидкості тепловідводу від горючої системи, що реагує, в стінки судини.
В точці дотику (при Т = Tсс) виконуються умови:

Фактична поява полум’я в горючій системі відбувається не в момент розігріву її до температури самоспалахування, а згодом ще деякий проміжок часу. Проміжок часу, протягом якого горюча суміш саморозігрівается від температури стінок судини Т0 до появи полум’яного горіння, називається періодом індукції теплового вибуху.
Величина індукційного періоду теплового вибуху залежить від виду горючої речовини; складу суміші (концентрації пального, окислювача і нейтральних газів), температури стінок судини; тиску в системі. Чим нижче температура початкового розігріву системи, тим більший період індукції. Тому за температуру самоспалахування приймають ту температуру стінок судини, при якій період індукції є максимальним.
Отже, індукційний період не є фізичною константою горючої речовини або системи, але може бути використаний як показник ступеню пожежної небезпеки горючих речовин та матеріалів.
2.2. Ланцюгова теорія самоспалахування
В теорії теплового вибуху нагрів є єдиною причиною прогресивного збільшення швидкості хімічної реакції і внаслідок цього швидкості тепловиділення. Хімічне перетворення саме по собі, з точки зору цієї теорії, є тільки гальмуючим фактором, оскільки по мірі витрачання вихідної речовини зменшується швидкість хімічних реакцій. Між тим великий клас хімічних реакцій, до якого відносяться і всі реакції окислення вуглеводів повітрям і киснем, відносяться до хімічного перетворення, швидкість якого зростає по мірі накопичення продуктів реакції.
Для ініціювання таких реакції необхідно яким-небудь стороннім джерелом забезпечити утворення деякої початкової концентрації каталізуючого продукту - активних центрів. Ці центри викликають хімічні перетворення, при яких знов утворюються активні центри, виникає розгалужена ланцюгова реакція. Швидкість ланцюгової реакції відображається рівнянням:
Wланц.реакц. = Wo + Wf - Wg
За умови перевищення швидкості розгалуження над швидкістю обриву ланцюгів в системі загальна швидкість хімічної реакції окислення збільшується, і при певному її значенні виникає займання.
ВИСНОВОК: В випадку екзотермічних реакцій окислення пальних речовин завжди існують такі умови, при яких швидкість виділення тепла від реакції перевищує швидкість тепловіддачі від газу, що реагує, через стінки судини. Так створюється безперервне, зростаюче в часу збільшення швидкості реакції і підвищення температури системи, доки не буде досягнута дуже велика та неконтрольована швидкість тепловиділення, що характеризує запалення.
