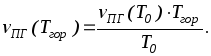- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
3.1 Визначення матеріального балансу
При горінні відбувається взаємодія між молекулами горючої речовини та окислювача, при цьому утворюються продукти горіння.
Горюча речовина + Окислювач → Продукти горіння
Як правило, окислювачем при горіння виступає кисень повітря. Схематично хімічну реакцію горіння одного молю речовини в повітрі можна представити рівнянням:
|
ГР + β∙О2 + β ∙3,76∙ N2 = Σni ∙ПГi + β ∙3,76 ∙N2, |
(3.1) |
де ГР – горюча речовина;
ПГ – продукти горіння;
Β, ni – стехіометричні коефіцієнти.
Це рівняння відображає лише вихідний і кінцевий стан системи, але не дає ніяких повідомлень про хід самої реакції, про ті проміжні стадії, через які проходить цей процес. Але для практичних розрахунків достатньо розглядати саме цю сумарну реакцію, яка і є узагальненим записом матеріального балансу реакції горіння.
Матеріальний баланс реакції горіння – співвідношення (рівність) між кількістю речовин, що вступають у реакцію, (горючої суміші) та кількістю речовин, що утворюються внаслідок цієї реакції – продуктів горіння.
Додержання умов матеріального балансу означає, що загальна маса компонентів реакції залишається незмінною, і визначається на підставі рівняння реакції та інформації про хімічний склад і фізичний стан речовин.
|
Σmгс = Σ mпг. |
(3.2) |
Безпосередньо у реакції горіння беруть участь горюча речовина і окислювач, однак в вихідній суміші можуть бути присутні також нейтральні речовини - азот, аргон, діоксид вуглецю та інші речовини, які переходять без зміни хімічного складу в продукти горіння. Незважаючи на те, що такі речовини не беруть участь в хімічних перетвореннях, їх присутність теж необхідно враховувати, бо вони будуть впливати на температурний режим реакції горіння. Частина теплової енергії, що виділяється при горінні, іде на нагрів цих нейтральних домішок.
Горюча суміш, склад якої відповідає рівнянню реакції горіння, називається стехіометричною. Такі суміші є найбільш реакційноздатними, а, отже, найбільш пожежонебезпечними, бо вони легше спалахують, виділяють найбільшу кількість тепла. Тому в практичній діяльності необхідно вміти передбачати та розраховувати умови, при яких дана горюча речовини буде утворювати з повітрям найбільш небезпечні в пожежному відношенні системи.
3.2 Витрата повітря на горіння
Розрізняють питому та повну, теоретичну та дійсну кількість повітря, яка витрачається на згоряння горючої речовини.
Питома кількість повітря - кількість повітря, яка необхідна для згоряння одиниці кількості горючої речовини (1моль, 1 м3, 1 кг);
Повна кількість повітря - кількість повітря, яка необхідна для згоряння певної кількості горючої речовини;
Теоретична кількість повітря - мінімальна кількість повітря, яка необхідна для повного згоряння горючої речовини;
Дійсна кількість повітря - кількість повітря, яка витрачається на згоряння горючої речовини при заданих умовах.
Мінімальна кількість повітря, яка необхідна для повного згоряння одиниці кількості горючої речовини (1 моль, 1м3, 1 кг), називається питомим теоретичним об’ємом повітря і позначається v0п. В дійсності кількість повітря, що поступає в зону горіння, відрізняється від теоретичного об’єму. Такий об’єм повітря, що приходиться на одиницю кількості горючої речовини, називається питомим дійсним об’ємом і позначається vп.
Для характеристики ступеня забезпеченості повітрям використовують поняття коефіцієнта надлишку повітря (п ), що показує, у скільки разів кількість повітря, що дійсно надходить до зони горіння, відрізняється від теоретично необхідної кількості для повного згоряння горючої речовини.
|
|
(3.3) |
де vоп – питомий теоретичний об’єм повітря, необхідний для повного згоряння горючої речовини;
vп - питомий дійсний об’єм повітря, що надходить до зони реакції в дійсності при згорянні горючої речовини.
Отже, дійсний питомий об’єм повітря дорівнює
|
|
(3.4) |
Різниця між кількістю повітря, що іде на горіння і теоретично необхідною, називається надлишком повітря, який переходить у продукти горіння.
|
|
(3.5) |
У випадку кінетичного горіння за умови п = 1 (vоп = vп) суміш горючої речовини з повітрям є стехіометричною. Якщо п 1, суміш має нестачу окислювача і надлишок горючої речовини і називається “багатою”. Характерною рисою процесу горіння в цьому випадку є утворення продуктів неповного згоряння. Якщо п 1, суміш є “бідною”, бо в ній нестача горючої речовини і надлишок окислювача. При цьому продукти горіння містять надлишок повітря vп.
Для кінетичного горіння існують критичні значення коефіцієнта надлишку повітря п min та п mах , які відповідають сумішам з критичним вмістом кисню та горючої речовини відповідно. Ці значення можуть бути розраховані за формулою:
|
|
(3.6) |
Мінімальний коефіцієнт надлишку повітря п min відповідає верхній концентраційній межі поширення полум’я в (найбільшому вмісту горючої речовини в суміші з окисником, за якого може існувати горіння), а максимальний коефіцієнт надлишку повітря п mах – нижній концентраційній межі поширення полум’я н (найменшому вмісту горючої речовини в суміші з окисником, за якого може існувати горіння).
Під час дифузійного горіння кисень надходить в зону горіння з навколишнього середовища, де він міститься в кількості 21% від загального об’єму повітря. В процесі вигоряння кількість кисню зменшується, а продуктів горіння збільшується, частина повітря, що надходить, змішується з продуктами горіння. Це уповільнює процес дифузії окислювача в зону горіння, а, отже, зменшується швидкість реакції горіння, при цьому утворюються продукти неповного згоряння, незважаючи на те, що загальна кількість повітря буде достатньою для повного окислення горючої речовини. Коли вміст кисню у повітрі зменшується до 14%, полум’яне горіння, у більшості випадків, припиняється, але може існувати гетерогенне горіння, для підтримування якого достатньо приблизно 5 % кисню.
Таким чином, під час дифузійного горіння коефіцієнт надлишку повітря практично завжди більше 1. Коефіцієнт надлишку повітря можна визначити як відношення відсоткового вмісту кисню у повітрі до його відсоткового вмісту у продуктах горіння:
|
|
(3.7) |
Отже, найменший коефіцієнт надлишку повітря під час дифузійного горіння за умови, що утворюються лише продукти повного згоряння, складає:
|
|
(3.8) |
В умовах пожежі процес горіння завжди протікає за фактичної нестачі повітря, тобто відбувається неповне згоряння, тоді в продуктах горіння містяться такі речовини, як СО, СН4, Н2, доокислення яких проходить після зони реакції. Отже вміст кисню в продуктах горіння зменшується на кількість, яка необхідна для доокислення горючих компонентів продуктів згоряння:
|
|
(3.9) |
При цьому коефіцієнт надлишку повітря наближається до 2.
Прогнозувати параметри процесу горіння (об’єм повітря, об’єм і склад продуктів горіння, температуру горіння) можливо лише для сумішей, в яких коефіцієнт надлишку повітря більше одиниці. Для багатих сумішей такого аналізу не вдається провести із-за складності кінетики утворення продуктів неповного згоряння.
3.3 Продукти горіння. Дим та його властивості
Внаслідок реакції утворюються продукти горіння.
Продукти горіння – це газоподібні, тверді та рідкі речовини, що утворюються при взаємодії окислювача з горючою речовиною у процесі горіння.
Склад продуктів горіння залежить від складу горючої речовини та умов протікання реакції горіння. До продуктів горіння переходять і нейтральні домішки, що знаходились у вихідній суміші, і та частина горючого або окислювача, яка не брала участі у реакції.
У процесі горіння окрім продуктів повного і неповного згоряння утворюються продукти термоокислювального розкладу органічних речовин внаслідок попереднього нагрівання горючих речовин. Це відбувається за рахунок передачі тепла перед факелом полум’я або у верхній частині приміщення, де знаходяться розжарені продукти горіння. Склад продуктів термоокислювального розкладу залежить від природи горючих речовин, температури та умов контакту з окислювачем (вода, спирти, альдегіди, кетони, HCl, HCN, H2S та ін.).
Продукти горіння можна класифікувати:
за агрегатним станом:
Газоподібні Рідкі Тверді
До газоподібних відносяться вуглекислий газ, окис вуглецю, хлористий водень, ціанистий водень і т.п.. Рідкими продуктами горіння є: вода, сірчана кислота, проміжні продукти розкладу та окислення горючої речовини, наприклад, карбонові кислоти, альдегіди та ін. У твердому агрегатному стані знаходяться такі продукти горіння, як вуглець (сажа), оксиди металів (Na2O, CaO, Al2O3 ), оксиди неметалів (Р2О5 , SiO2). Саме тверді та рідкі продукти горіння обумовлюють непрозорість системи, що утворюється при горінні.
за повнотою згоряння.
Залежно від умов протікання процесу горіння, пов'язаними з особливостями надходження повітря до зони реакції горіння, всі продукти можна розділити на
продукти повного згоряння та продукти неповного згоряння.
Продукти повного згоряння це ті хімічні компоненти, що утворюються при повному окисленні речовини киснем (H2O, CO2, SO2, і т.п.). Всі вони не здатні горіти і не підтримують горіння більшості інших речовин. При складанні рівняння реакції горіння ми вважаємо, що при горінні утворюються лише продукти повного згоряння. Але насправді на пожежі навіть при достатньо інтенсивному надходженні повітря можуть утворюватися продукти неповного згоряння, (С, СО, H2S), а також продукти термоокислювального розкладання (спирти, альдегіди, кетони та ін.). Необхідно пам’ятати, що продукти термоокислювального розкладання є найбільш токсичними. За статистичними даними майже 70% всіх загиблих на пожежі постраждали через отруєння токсичними продуктами горіння.
за хімічним складом.
Хімічно інертні та Реакційноздатні.
Хімічно інертні речовини це, як правило, кінцеві продукти реакції горіння, які не здатні до подальших хімічних перетворень за нормальних умов або під час пожежі. Реакційноздатні компоненти можуть вступати в хімічні реакції в цих умовах. До реакційоздатних відносяться всі продукти неповного згоряння, які подальше можуть вступати в реакцію доокислення, а також деякі продукти повного згоряння, наприклад HCl, які можуть вступати в реакції обміну.
В цілому продукти згоряння утворюють систему, що зветься димом.
Димом називається дисперсна система, що складається з твердих і рідких часток (дисперсної фази), завислих у газовому дисперсійному середовищі.
Розміри дисперсної фази змінюються від 10-5 до 10-8 м. Частки диму, що мають малу масу і високу питому поверхню, дуже повільно осідають. Їх розміри сумірні з довжиною вільного пробігу молекул. Тому стійкості системи сприяє броунівський рух, в якому находяться тверді частки під дією ударів об їх поверхню молекул газу. Це зумовлює кінетичну стійкість диму.
Крім того, конденсовані частки несуть на собі однойменний електричний заряд. Частки дисперсної фази можуть набувати електричний заряд при терті о дисперсійне газове середовище, або за рахунок адсорбції на їх поверхні іонів, що утворюються при горінні. Внаслідок цього частки відштовхуються одна від одної, що перешкоджає їх злипанню та коагуляції та зумовлює агрегативну стійкість диму.
Властивості диму характеризуються наступними параметрами:
1. Концентрація диму – це кількість продуктів горіння, що містяться в одиниці об’єму. У зоні задимлення концентрація продуктів горіння знаходиться в інтервалі від 1•10 - 4 до 5•10 - 3 кг/м3.
2. Непрозорість диму, обумовлена присутністю твердої фази. Тверді частки поглинають та розсіюють світло. Ступінь зниження прозорості залежить від концентрації, розміру та природи часток дисперсної фази. Параметром, що характеризує задимлення, є густина задимлення.
Густина задимлення – відношення інтенсивності світла Iп, яке пройшло через шар диму, до інтенсивності світла I0, що падає.
|
Dд = Iп /I0 = exp(-K∙G∙lш) |
(3.10) |
де К – коефіцієнт поглинання;
G – масова концентрація диму, кг/м3;
lш – товщина шару диму, м.
На практиці густину задимлення визначається по прониканні променя переносного пожежного ліхтаря і, виходячи з цього, задимлення може бути:
- сильним (видимість до 3 метрів);
- середнім (видимість від 3 до 6 метрів);
- слабким (видимість від 6 до 12 метрів).
3. Знижений вміст кисню. Зниження концентрації кисню нижче 21% призводить до кисневого голодування особового складу, що бере участь у гасінні пожежі, а при зниженні концентрації нижче 16% робота особового складу без індивідуальних засобів захисту органів дихання неможлива. З цією метою у пожежній охороні організована газодимозахисна служба, а особовий склад використовує киснево-ізолюючі протигази.
4. Токсичність продуктів горіння - це здатність продуктів горіння викликати отруєння людей, які знаходяться без індивідуальних засобів захисту органів дихання.
Показником токсичності диму називається середня смертельна концентрація диму L50 – вміст летючих продуктів горіння і термоокислювального розкладання матеріалу, за якого виникає загибель 50% піддослідних тварин за заданої експозиції (звичайно експозиція тварин відбувається протягом 5 хвилин). Показник токсичності диму використовують для порівняльної оцінки токсичності продуктів горіння різних матеріалів в умовах пожежі.
5. Підвищена температура диму. Температура продуктів горіння безпосередньо біля осередку горіння досягає 1000оС, але у приміщеннях температура диму може бути істотно нижчою, в залежності від умов газообміну. Головним фактором, що впливає на температуру диму, є коефіцієнт надлишку повітря. При його збільшені температура продуктів горіння знижується. Небезпечною температурою є вже температура 70оС, робота особового складу при такій температурі тривалий час пов'язана з ризиком для життя із-за перегріву організму.
Отже, дим являє собою велику небезпеку, що обумовлено:
- високою температурою;
- токсичністю продуктів горіння;
- непрозорістю диму, що знижує видимість і ускладнює евакуацію людей і дії особового складу при гасінні пожежі;
- вмістом продуктів термоокислювального розкладу та продуктів неповного згоряння, які можуть утворювати вибухонебезпечні суміші з повітрям.
Продукти неповного згоряння, що утворюються під час горіння речовин і матеріалів у закритих приміщеннях, при надходженні свіжого повітря можуть утворювати вибухонебезпечні суміші, що займаються від джерел запалювання. Горюча суміш при цьому горить у кінетичному режимі (вибухове горіння).
Існує декілька способів боротьби з димом, які знижують його небезпеку. До них відносяться такі як: використання розпорошених струменів води, при цьому знижується температура диму, збільшується його вологість, відбувається нейтралізація заряджених часток, їх злипання та осаджування. Крім того, для боротьби з димом можуть використовуватися методи видалення за допомогою димососів або створення конвекційних потоків за допомогою димових люків.
Висновок: У процесі горіння на пожежі речовини вступають в реакції у певних співвідношеннях. Внаслідок реакції утворюються продукти горіння, що можуть знаходитися в різних агрегатних станах. Конкретний вид продуктів горіння залежить від умов реакції та виду речовин, що реагують. При гасінні пожеж необхідно пам'ятати про вибухонебезпечні та токсичні властивості продуктів горіння. Організовуючи гасіння пожеж, слід вживати заходи для захисту особового складу від отруєння і можливих вибухів продуктів горіння.
3.4 Горіння газу індивідуального складу
Треба пам’ятати, що 1 кіломоль газу при заданих температурі Т та тиску Р займає об’єм Vμ , м3, який можна розрахувати за формулою:
|
|
(3.11) |
За однакових умов (Р і Т) різні гази займають однаковий об’єм.
Коли горить газ, то на 1 кмоль (vμ ГР, м3) горючої речовини витрачається теоретичний об’єм (n0п ∙ vμ п) м3 або дійсний об’єм (n0п ∙ vμ п) м3 повітря.
1 кмоль ГР — n0п= 4,76∙ β, кмолей повітря.
vμ ГР, м3 ГР — n0п ∙ vμ п= 4,76∙ β ∙ vμ п, м3 повітря.
1 м3 ГР — v0п , м3 повітря.
З цієї пропорції можна визначити питомий теоретичний об’єм повітря, що необхідний для згоряння одного кубічного метру горючого газу:
|
|
(3.12) |
Якщо горюча речовина знаходиться за тих само умов, що і повітря, то vμ ГР= vμ п, отже на згоряння 1 м3 ГР буде витрачатися:
питомий теоретичний об’єм повітря
|
v0п = 4,76∙ β , м3/м3; |
(3.13) |
питомий дійсний об’єм повітря
|
vп = 4,76∙ β∙ α п, м3/м3. |
(3.14) |
При горінні заданої кількості горючого газу vг.г. ,м3 можна визначити повні об’єми повітря:
повний теоретичний об’єм повітря
|
v0п(повн) = v0п ∙vг.г. ., м3; |
(3.15) |
повний дійсний об’єм повітря
|
vп(повн)= vп ∙vг.г. ., м3. |
(3.16) |
Так само можна отримати і об’єми продуктів горіння, що утворюються при згорянні горючої речовини в газоподібному стані.
1 кмоль ГР — n0ПГ = ∑nПГi , кмолей ПГ.
vμ ГР, м3 ГР — n0ПГ ∙ vμ ПГ, м3 ПГ.
1 м3 ГР — v0ПГ , м3 ПГ.
|
|
(3.17) |
Якщо продукти згоряння знаходяться за тієї самої температури і тиску, що і горючий газ, то Vμ ГР= Vμ ПГ, при цьому можна визначити питомі та повні об’єми продуктів згоряння:
питомий теоретичний об’єм ПГ
|
v0ПГ=∑nПГi , м3/м3; |
(3.18) |
питомий дійсний об’єм ПГ
|
vПГ=v0ПГ+Δvп=∑nПГi +(αп-1)∙4,76∙β , м3/м3. |
(3.19) |
повний теоретичний об’єм ПГ
|
v0ПГ(повн) = v0ПГ∙ vг.г.., м3; |
(3.20) |
повний дійсний об’єм ПГ
|
vПГ(повн) = vПГ∙vг.г.., м3. |
(3.21) |
Проте під час горіння продукти горіння мають високу температуру (температуру горіння), при цьому відбувається їх температурне розширення. Зміну об’єму продуктів горіння можна визначити з універсального газового закону:
|
|
(3.22) |
де Т0 - початкова температура, К;
Тгор - температура продуктів горіння, К;
vПГ(Тгор). - об’єм продуктів горіння при Т0, м3.