
- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
2.3 Продовження ланцюгів
Характерною особливістю нерозгалужених ланцюгових реакцій є квазістаціонарність концентрації активних центрів. За відсутності обриву ланцюгів активні частинки утворюються в
такій же кількості, в якій і витрачаються. Нові виникають лише при початковій ініціації. При рівності швидкостей генерування активних центрів і обриву ланцюгів встановлюється постійна концентрація активних центрів і стаціонарний режим реакції. Швидкість реакції знижуватиметься у міру витрачання початкових компонентів.
У разі протікання розгалуженої ланцюгової реакції концентрація активних центрів в реагуючій системі зростає незалежно від умов їх початкової ініціації. Реалізується режим реакції, що самоускоряющийся, має лавиноподібний характер. В цьому випадку для повного перетворення початкових компонентів на кінцеві продукти реакції достатньо одного початкового активного центру.
Кінетичне рівняння розгалуженої цінної реакції виглядає таким чином. Зміною концентрацій стійких початкових компонентів в часі в першому наближенні можна нехтувати, а враховувати тільки швидші зміни концентрації активних центрів п. Зміни цій швидкості визначається швидкістю початкового инициированияи співвідношенням швидкостей реакцій розгалуження і обриву ланцюгів. Швидкість початкової ініціації не залежить від концентрації присутніх в системі активних центрів. Швидкості процесів розгалуження і обриву пропорційні концентраціям активних центрів. За цих умов загальний баланс освіти і витрачання активних центрів визначається сумою швидкостей процесів ініціації, розгалуження і обриву:
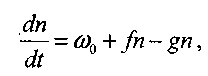
де f та g - константи швидкостей реакцій розгалуження і обриву. Позначивши f-g = φ, отримаємо:
![]()
За
![]() похідна
за часом концентрації активних центрів
позитивна. При цьому швидкість реакції
зростає в часі. Ця особливість розгалужених
ланцюгових реакцій обумовлена розмноженням
активних центрів при таких режимах,
коли швидкість реакції розгалуження
перевищує швидкість реакції обриву
ланцюгів.
похідна
за часом концентрації активних центрів
позитивна. При цьому швидкість реакції
зростає в часі. Ця особливість розгалужених
ланцюгових реакцій обумовлена розмноженням
активних центрів при таких режимах,
коли швидкість реакції розгалуження
перевищує швидкість реакції обриву
ланцюгів.
Якщо до початку реакції система не містила активні центри, тобто при t = 0, n = 0 інтеграція рівняння (2.2) дає:

Сумарна швидкість реакції З визначається швидкістю процесу розгалуження. Кінцеві продукти утворюються тільки при цій реакції. На кожен елементарний акт розгалуження ланцюга образуютсямолекул кінцевого продукту. З цього виходить:
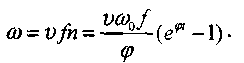
Розвиток ланцюгової реакції в часі визначається співвідношенням констант швидкостей реакцій розгалуження і обриву ланцюгів f та g При f > g , тобто при φ=0 показник експоненти в рівнянні (2.4) позитивний і реакція необмежено самоприскорюється. У початковий період розвитку реакції справедливе співвідношення
![]()
Унаслідок того, що швидкість початкової ініціації мала, помітне хімічне перетворення на початковий період відсутнє. Через деякий час величинастановится істотно більше одиниці. Після цього швидкість реакції відповідно до рівняння (2.4) починає швидко зростати і досягає дуже великих значень, хоча до цього була практично невідчутною.
Наявність періоду затримки (періоду індукції) при розвитку ланцюгової реакції обумовлена необхідністю накопичення в реагуючій системі певної кількості активних центрів. Тільки після цього хімічне перетворення стає помітним.
Величину періоду індукції при ланцюгових реакціях визначають співвідношення швидкостей процесів розгалуження і обриву ланцюгів, а не швидкість початкової ініціації. У свою чергу швидкості реакцій розгалуження і обриву обумовлені хімічними особливостями кожної реагуючої системи, визначаються залежностями від температури і концентрацій початкових компонентів. Особливість ланцюгових реакцій полягає в тому, що процеси розгалуження вимагають значної енергії активації, тоді як температурний коефіцієнт константи швидкості процесу обриву близький до нуля. У реакцій обриву ланцюгів всіх трьох типів: при об'ємній і гетерогенній рекомбінаціях, при взаємодії радикалів з активними домішками енергії активації рівні нулю.
При підвищенні температури, загального тиску суміші або зміні концентрації реагуючих компонентів можлива така зміна констант швидкостей розгалуження і обриву, при якому реакція переходить від стаціонарного режиму до нестаціонарного. Особливість цього процесу полягає в скачкообразности переходу від одного режиму до іншого, в зміні швидкості реакції від нехтує малої величини до що необмежено зростає.
Протікання деяких ланцюгових реакцій супроводжується утворенням проміжних продуктів, що відрізняються порівняльною стійкістю, але що при цьому володіють здатністю генерувати активні центри. До таких реакцій відносяться, наприклад, реакції горіння вуглеводнів, як проміжні продукти при яких утворюються перекиси і альдегіди. Це приводить до розгалужень ланцюга. Проте, унаслідок відносної стійкості проміжних продуктів прискорення реакції розтягується в часі. Подібні сповільнені розгалуження ланцюгів називаються виродженими.
Ланцюгові реакції із звичайним радикальним механізмом розгалуження, як правило, із-за високої активності радикалів протікають достатньо швидко. Радикали, що утворюються, або ініціюють реакцію, що швидко прискорюється, або рекомбинируют і виходять з про-цесса.
Обрив ланцюгів. Активна частинка, як і всяка газова молекула, здійснює усередині реагуючої системи хаотичні рухи, стикаючись з іншими молекулами. При цьому існує певна вірогідність при якомусь зіткненні взаємодії з іншою активною частинкою або молекулою і утворення нової активної частинки, що продовжує шлях попередньої. Розвиток ланцюга реакції аналогічно броунівському руху інертних молекул, хоча перенесення активних центрів супроводжується хімічною реакцією. На шляху розвитку ланцюга чергуються активні центри два або більш за типи.
Ланцюг реакцій триває до моменту, коли активна частинка не вступить в реакцію без регенерації. В цьому випадку відбувається так званий обрив ланцюга. Процеси обриву грають велику роль в кінетиці ланцюгових реакцій. Можливі два типи реакцій, ведучі до загибелі активних центрів:
гомогенний обрив (загибель в об'ємі реагуючої суміші);
гетерогенний обрив (загибель на твердій поверхні)
Гомогенний обрив ланцюгів можливий при одному з двох процесів:
при рекомбінації радикалів або при взаємодії різних хімічно активних компонентів з активними центрами без регенерації останніх.
Гетерогенний обрив ланцюгів відбувається на частинках сажі, що утворюється при горінні, або на поверхні твердих матеріалів, що горять. Обрив ланцюгів на твердій поверхні можна розглядати як дифузію активних центрів з газової суміші до цієї поверхні, на якій вони зникають. Механізм рекомбінації на твердій поверхні полягає в тому, що активна частинка, що володіє підвищеною реакційною здатністю, сорбируется* на поверхні. Сорбовані на сусідніх ділянках радикали рекомбинируют між собою, оскільки для цього процесу не існує енергетичних і просторових перешкод. Рекомбінації молекули стійких з'єднань, що утворилися в результаті, не беруть участь більше в розвитку ланцюгової реакції.
Проте не кожне зіткнення активної частинки з твердою поверхнею приводить до її адсорбції. Можливе її віддзеркалення від поверхні. Вірогідність адсорбції активного центру твердою поверхнею називається коефіцієнтом акомодації. Цей коефіцієнт є характеристикою хімічної спорідненості активної частинки і поверхні. У практично важливих випадках активна частинка після віддзеркалення від стінки не віддаляється від неї далеко. Існує вірогідність нових зіткнень із стінкою до тих пір, поки не відбудеться її акомодація. Із-за цього процесу в певних умовах швидкість реакції практично не залежить від коефіцієнта акомодації. Процес протікає таким чином, як якби обрив ланцюга відбувався при кожному зіткненні. Концентрацію активних центрів у поверхні можна приймати рівною нулю.
За відсутності в реагуючій суміші активних домішок обрив ланцюгів може відбуватися або на твердих поверхнях, або гомогенно шляхом рекомбінації радикалів в об'ємі. При реальних пожежах реалізується, в основному, другий шлях.
Певний вплив на кінетику ланцюгових реакцій роблять добавки в реагуючу систему інертних газів. Інертні добавки збільшують число зіткнень з активними частинками, збільшують вірогідність обриву ланцюгів і, відповідно, гальмують загальну реакцію.
Ефективніше гальмування ланцюгових реакцій досягається при введенні в реагуючу суміш хімічно активних добавок - інгібіторів. Інгібітори взаємодіють з активними центрами, ведучими реакцію, обриваючи ланцюги. Кінетика реакції в ингибированной суміші визначається умовами конкуренції інгібітору і основних компонентів реакції при взаємодії з активними центрами. При високій ефективності інгібітору і помірної швидкості генерування нових активних центрів вже невеликі добавки інгібітору можуть повністю пригнічувати протікання ланцюгової реакції.
Процеси ингибірування мають велике значення в практиці по-жаровзрывобезопасности. Використання інгібіторів дозволяє ефективно впливати на процеси горіння.
