
- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
Хімічне самозаймання
Хімічним називається самозаймання, яке виникає внаслідок взаємодії речовин, реагуючих з виділенням тепла.
У залежності від характеру окислювача, який вступає в реакцію з горючим матеріалом, цей вид самозаймання можна поділити на три групи:
самозаймання при контакті з киснем повітря,
самозаймання при контакті з водою;
самозаймання при контакті з хімічним окислювачем.
Крім того, самозаймання при контакті з хімічними окислювачами ділять на три підкласи в залежності від агрегатного стану окислювача.
Хімічне самозаймання при контакті речовин з киснем повітря
Речовини, які здатні самозайматися при контакті з повітрям і мають температуру самонагрівання нижче за 50оС, називаютьпірофорними. До цієї групи речовин можна віднести:
1. Індивідуальні хімічні речовини, які мають високу хімічну активність і здатні бурхливо реагувати на повітрі:
- лужні метали, що мають велику молекулярну масу (рубідій та цезій);
- метали в порошкоподібному стані (цинкова, магнієва, алюмінієва пудра);
– білий фосфор.
2. Металоорганічні сполуки (МОС) - органічні речовини, що вмістять атоми металів (етилат натрію С2Н5ОNa, триетілалюміній(С2Н5)3А1).
3. Елементоорганічні сполуки - речовини, в структурі яких міститься атоми силіцію, фосфору, арсену (безбарвний газ силан SiH4, рідкий фосфористий водень Р2Н4, арсенід водню Н3As)
4. Пірофорне сірчисте залізо.
5. Жири і олії, а також матеріали на їх основі, такі як оліфа, лаки, фарби, лінолеум.
Всі ці речовини здатні окислюватися на повітрі з виділенням значної кількості тепла, за рахунок якого реакція самоприскорюється до виникнення горіння самих речовин або інших горючих речовин, які знаходяться в контакті. Деякі із перелічених речовин самозаймаються дуже швидко після зіткнення з повітрям, інші - через тривалий проміжок часу.
Розглянемо причини самозаймання цих речовин.
Лужні, лужноземельні метали та алюміній на повітрі окислюються. Рубідій та цезій - найбільш реакційноздатні, тому вони самозаймаються навіть в компактному вигляді, а інші - у вигляді порошків.
К + О2 = КО2 + 283,8 кДж.
Дисперсність часток, при якій виявляється схильність до самозаймання, різна для різних металів. Для цирконію, найбільше схильного до самозаймання, ця здатність виявляється при частках розміром до 3 мкм. Частки розміром 12 мкм не загоряються навіть при нагріві їх до почервоніння. Залізо, нікель, мідь самозаймаються при частках розміром 0,01 – 0,03 мкм. Натрій і цирконій при частках таких розмірів спалахують на повітрі миттєво.
Волога сприяє самозайманню, отже в вологому повітрі горіння виникає легше і скоріше, ніж у сухому. Тому алюмінієву пудру виготовлюють лише в середовищі інертного газу і потім перетирають парафіном, плівка якого запобігає окисленню метала. У випадку, коли під дією розчинника парафін зникає з поверхні порошку, відбувається самозаймання.
Дуже небезпечним є фосфор (білий та жовтий). На повітрі він інтенсивно окислюється, внаслідок чого швидко самонагрівається та самозаймається. Температура його самоспалахування нижче 20оС.
2Р + 2,5О2 = Р2О5 + 1550 кДж.
Зберігають фосфор під водою. Розчиняється фосфор лише у сірковуглецю. Такі розчини використовували як запальні: після змочування ними горючих речовин відбувалось випаровування сірковуглецю, а фосфор, що залишався на поверхні горючої речовини тонким шаром, швидко окислювався та самозаймався. При цьому займалася і горюча речовина.
Самозаймання сульфідів заліза
Сірководневі солі заліза (сульфіди FeS, FeS2, Fe2S3) здатні самозайматися при контакті з повітрям. Це явище може бути причиною виникнення пожежі.
В природі сульфід заліза знаходиться в виді FeS2 і має назву сірчаний колчедан або пірит, вміщується в кам’яному вугіллі, залізній руді. Окислення піриту супроводжується виділенням тепла:
FeS2 + О2 = FeS + SО2 +222,5 кДж.
Окисленню піриту сприяє волога, реакція в цьому випадку протікає таким чином:
2FeS2 + 7,5О2 + H2O = Fe2(SО4)3 + Н2SО4 +2777,5 кДж.
Сірчанокислотне залізо, що утворюється, збільшуючись в об'ємі, спричиняє розтріскування шматків піриту і їх подрібнення, при цьому збільшується площа контакту осадка з окислювачем, що приводить до зростання швидкості реакції та сприяє процесу самозаймання того горючого матеріалу, в якому міститься пірит.
Інші сульфіди утворюються в технологічній апаратурі, в якій обробляються або зберігаються продукти, що вміщують сірководень або інші сірковмісні речовини. Вони представляють більшу небезпеку, ніж сірчаний колчедан, тому що їх самозаймання відбувається в суміші повітря з горючими парами та газами.
Механізм виникнення сульфідів заліза в резервуарах і технологічних апаратах залежить від температурних умов. Якщо температура в апараті вище за температуру дисоціації сірководню (вище за 583 К), сульфіди заліза утворяться при взаємодії заліза з елементарною сіркою, що вийшла внаслідок розкладання сірководню або інших сірчистих сполук.
2 H2S +O2 = 2H2O + 2S.
Сірка, що виділилася, осідаючи на стінках апаратури, взаємодіє із залізом:
Fe +S = FeS.
Пірофорне залізо утворюється і при температурах нижче 300оС при тривалому контакті окислених залізних поверхонь при зберіганні нафти, в якій міститься сірководень. При цьому сірководень впливає не на залізо, а на продукти його корозії, протікають реакції типу
Fe2O3 + 3H2S = Fe2S3 + 3H2O
2Fe(OH)3 + 3H2S = Fe2S3 +6 H2O + Q
Причиною самозаймання всіх сульфідів є їх здатність окислюватися киснем повітря при звичайній температурі. Пірофорний осадок може накопичуватися на поверхнях апарату і при їх оголенні (наприклад при зливі нафтопродукту) контактувати з повітрям. При цьому протікають реакції окислення пірофорного заліза киснем повітря, які супроводжуються значним тепловиділенням. Горіння пірофорного заліза, в своїй суті безпечно, але його тепловиділення викликає самозаймання пари горючих рідин в об'ємі резервуара.
Профілактика процесів самозаймання пірофорних осадків в технологічному обладнанні і резервуарних парках - одна із задач, що вирішуються інспекторським складом ДПО на об'єктах хімічної, нафтохімічної і нафтопереробної промисловості.
Боротьба з самозайманням сульфідів заліза ведеться різними методами:
1) очищення від сірководню продукту, що зберігається; при цьому не будуть утворюватися сульфіди заліза;
2) обробка антикорозійним покриттям внутрішньої поверхні апаратури, при цьому не буде відбуватися контакт сірковмісних речовин з залізом;
3) продувка апаратури парою або продуктами горіння, для витіснення з обладнання пари горючих рідин та кисню;
4) заповненням апаратури водою і повільним спуском її для запобігання утворення горючого середовища всередині обладнання.
Самозаймання жирів і олій
Даний вид самозаймання часто є причиною виникнення пожеж, тому працівникам пожежної охорони необхідно знати причини, механізм протікання цього процесу і, відповідно до цього, розробляти і застосовувати різні заходи профілактики.
За своєю природою жири і масла можна класифікувати на мінеральні, рослинні і тваринні.
До мінеральних відносять масла, отримані в процесі переробки нафти (машинне, трансформаторне, солярове і ін.). Такі масла являють собою суміш в основному насичених вуглеводнів, які окислюються на повітрі тільки при високих температурах, і тому до самозаймання не схильні.
Однак, в практиці бувають випадки пожеж, причиною яких є самозаймання ганчірок, що просочилися мінеральними маслами. Це пояснюється тим, що в складі відпрацьованих мінеральних масел, що зазнавали нагріву до високих температур, з'являється значна кількість ненасичених вуглеводнів, схильних до самозаймання.
Масла і жири рослинного і тваринного походження відрізняються по своєму складу від мінеральних. Вони являють собою суміш гліцеридів високомолекулярних органічних кислот. Гліцериди – це складні ефіри гліцерину і карбонових кислот, які утворюються за реакцією етерифікації.
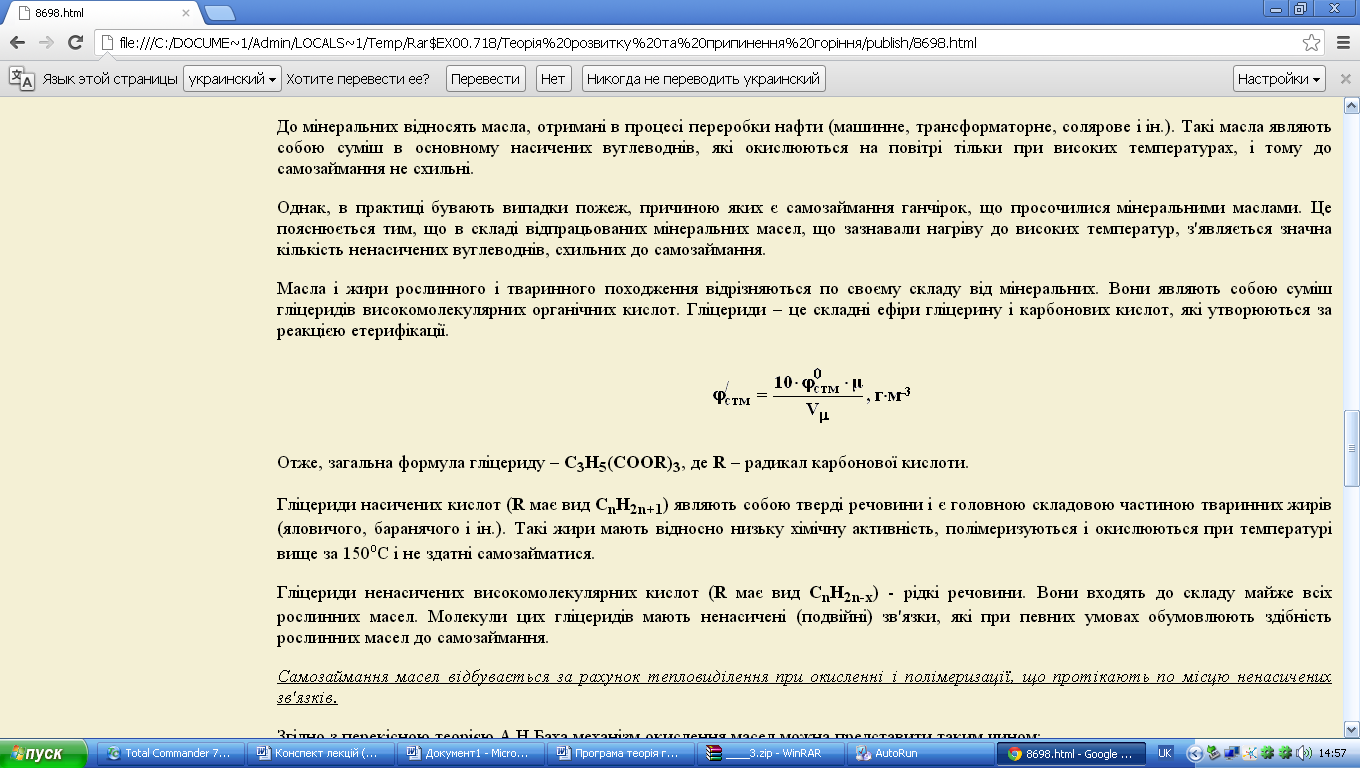
Отже, загальна формула гліцериду – С3Н5(СООR)3, де R – радикал карбонової кислоти.
Гліцериди насичених кислот (R має вид СnH2n+1) являють собою тверді речовини і є головною складовою частиною тваринних жирів (яловичого, баранячого і ін.). Такі жири мають відносно низьку хімічну активність, полімеризуються і окислюються при температурі вище за 150оС і не здатні самозайматися.
Гліцериди ненасичених високомолекулярних кислот (R має вид СnH2n-х) - рідкі речовини. Вони входять до складу майже всіх рослинних масел. Молекули цих гліцеридів мають ненасичені (подвійні) зв'язки, які при певних умовах обумовлюють здібність рослинних масел до самозаймання.
Самозаймання масел відбувається за рахунок тепловиділення при окисленні і полімеризації, що протікають по місцю ненасичених зв'язків.
Згідно з перекісною теорією А.Н.Баха механізм окислення масел можна представити таким чином:
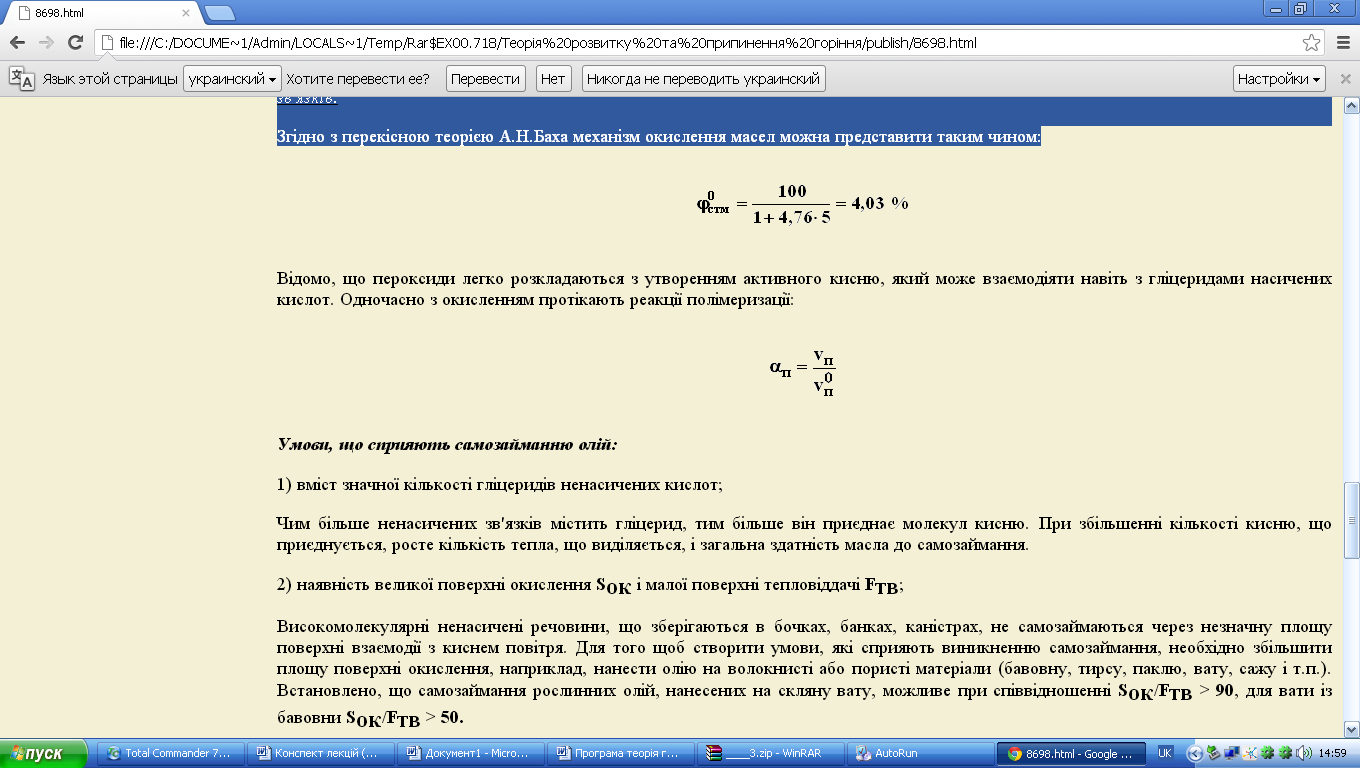
Відомо, що пероксиди легко розкладаються з утворенням активного кисню, який може взаємодіяти навіть з гліцеридами насичених кислот. Одночасно з окисленням протікають реакції полімеризації:
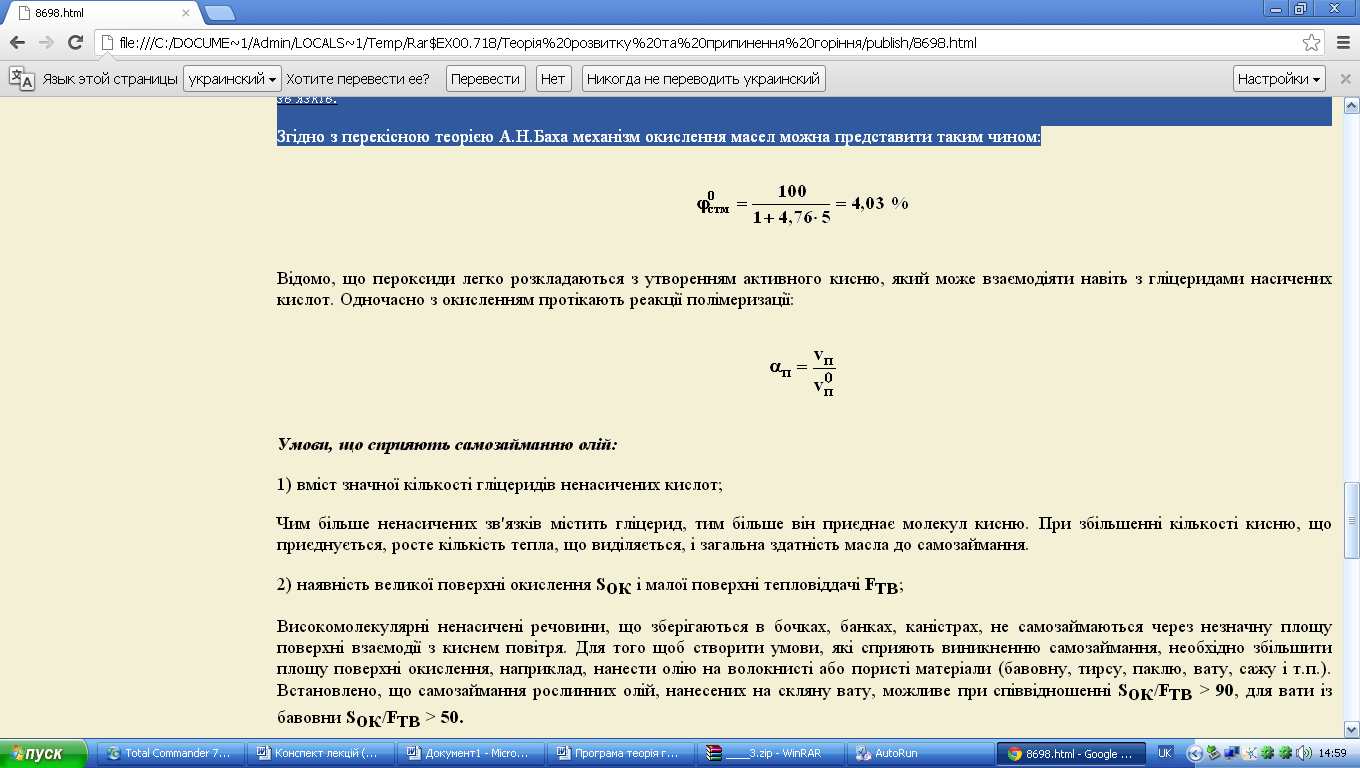
Умови, що сприяють самозайманню олій:
1) вміст значної кількості гліцеридів ненасичених кислот;
Чим більше ненасичених зв'язків містить гліцерид, тим більше він приєднає молекул кисню. При збільшенні кількості кисню, що приєднується, росте кількість тепла, що виділяється, і загальна здатність масла до самозаймання.
2) наявність великої поверхні окислення Sок і малої поверхні тепловіддачі Fтв;
Високомолекулярні ненасичені речовини, що зберігаються в бочках, банках, каністрах, не самозаймаються через незначну площу поверхні взаємодії з киснем повітря. Для того щоб створити умови, які сприяють виникненню самозаймання, необхідно збільшити площу поверхні окислення, наприклад, нанести олію на волокнисті або пористі матеріали (бавовну, тирсу, паклю, вату, сажу і т.п.). Встановлено, що самозаймання рослинних олій, нанесених на скляну вату, можливе при співвідношенні Sок/Fтв > 90, для вати із бавовни Sок/Fтв > 50.
3) доступ повітря;
Якщо просочений матеріал має надлишок олії (пори матеріалу повністю заповнені рідиною), то зменшується площа поверхні, по якій може відбуватися контакт з киснем повітря, отже, зменшується інтенсивність тепловиділення і схильність до самозаймання.
4) температура навколишнього середовища не менше за 10оС;
Чим нижче температура навколишнього середовища, тим інтенсивніше відбувається процес тепловтрат від системи і процес самонагрівання може не привести до виникнення горіння
5) певна щільність промасленого матеріалу.
Визначальною умовою серед перелічених є наявність великої кількості ненасичених (подвійних) зв’язків, бо, навіть якщо будуть виконані всі інші умови, але речовина не схильна до реакцій окислення й полімеризації, то тепловиділення в системі не буде відбуватися, отже, самозаймання не виникне.
Визначити кількість подвійних зв'язків можна за допомогою йодометричного методу.
Даний метод заснований на здатності галогенів приєднуватися до речовин по місцю ненасичених (подвійних) зв'язків. При цьому карбонові кислоти втрачають ненасиченість. По кількості йоду, що прореагував, можна кількісно судити про ступінь ненасиченості карбонових кислот і про схильність жиру або масла, до складу яких входять гліцериди цих кислот, до самозаймання. Критерієм в такій оцінці служить йодне число (Jч), яке показує скільки грамів йоду приєднається в певних умовах до 100 грамів масла. Якщо Jч< 50 - масло не схильне до самозаймання, а якщо Jч >50 - схильне.
Для того, щоб визначити йодне число розрахунком потрібно знати кількісний та якісний склад масла.
Методика розрахунку схильності масла до самозаймання
Визначити число подвійних зв’язків в молекулі гліцериду, що входить до складу масла.
загальна формула: С3Н5(СООR)3, де R: СnH2n-х
число подвійних зв’язків:
Визначити молярну масу гліцериду Мгліц.
Визначити йодне число гліцериду, враховуючи, що до кожного подвійного зв’язку приєднається одна молекула йоду.

Визначити йодне число масла з урахуванням його кількісного складу.

де gi – масова частка і-го гліцериду в маслі.
Зробити висновок про схильність масла до самозаймання.
Хімічне самозаймання речовин при контакті з водою
Реакції деяких речовин з водою або вологою повітря протікають з виділенням значної кількості теплоти, під дією якої горючі продукти реакції і вихідні речовини займаються, а негорючі матеріали нагріваються до високої температури і можуть викликати займання горючих речовин, які знаходяться поблизу зони реакції.
В залежності від складу вихідних речовин при реакції з водою утворюються різні газоподібні продукти реакції: водень, ацетилен, метан, етан та інші гази. Саме ці гази спочатку будуть займатися під впливом теплоти хімічної реакції.
До групи речовин, які самозаймаються при контакті з водою, можна віднести лужні метали; гідриди металів (NaH; KH; CaH2); оксиди і пероксиди металів (СаО, Na2O2), карбіди металів (СаС2, К2С2), фосфіди та силіциди різних металів, деякі металоорганічні сполуки.
Всі лужні метали взаємодіють з водою. Реакція супроводжується виділенням водню і значної кількості тепла.
2Na +2 H2O = 2 NaOH + H2 + 366,5 кДж;
2К +2 H2O = 2 КOH + H2 + 393,9 кДж.
Водень, що виділяється, самозаймається і горить разом з металом.
H2 + O2 → H2O;
Na + O2 → Na2O.
Іноді взаємодія вказаних металів з водою супроводжується вибухом з розбризкуванням розплавленого металу.
Крім того, велика реакційна спроможність лужних металів обумовлює протікання реакції взаємодії цих металів з вологою повітря. При цьому на поверхні металу швидко утворюється плівка гідроокису.
Гідриди лужних і лужноземельних металів взаємодіють з водою з утворенням водню і гідроокису відповідного металу.
KH + H2O = KOH + H2 + 82,8 кДж;
LiH + H2O = LiOH + H2 + 132 кДж;
ВаH2 + 2H2O = Ва(OH)2 + 2H2 + 157 кДж.
Від теплоти реакції самозаймаються водень і гідрид металу:
H2 + O2 → H2O;
КН + O2 → К2O + H2O.
Взаємодія карбідів лужних металів з водою, особливо карбідів натрію і калію, протікає дуже бурхливо і може закінчуватися вибухом. Причому, метали згоряють повністю, а вуглець виділяється у вільному стані:
2Na2C2 + 2H2O + O2 = 4NaOH +4C + 1169,3 кДж;
2Li2C2 + 2H2O + O2 = 4LiOH +4C + 1260,8 кДж.
При взаємодії карбідів лужноземельних металів (карбід кальцію) зі стехіометричною кількістю води виділяється стільки тепла, що система розігрівається до 920oС і ацетилен, що утворюється в ході реакції, самозаймається:
СаС2 + 2H2O = Ca(OH)2 + C2H2 + 1177,9 кДж;
C2H2 +2,5O2 → 2CO2 + H2O + 1301 кДж.
При великій кількості води самозаймання ацетилену не відбувається.
Карбід берилію та алюмінію утворюють з водою метан:
Аl4C3 + 12H2O = 4Аl(OH)3 +3CН4 + 1508,6 кДж
Самозаймання при контакті з водою характерно також для фосфидів і силіцидів різних металів.
Фосфід кальцію при взаємодії з водою утворює фосфористий водень (фосфін):
Са3Р2 + 6 H2O = 3Са(ОН)2 + 2РН3 + 771 кДж.
Це горючий газ, але його температура самоспалахування дуже висока. Одночасно з РН3 виділяється деяка кількість рідкого фосфористого водню Р2Н4, який самозаймається на повітрі і здатен стати причиною спалахування РН3.
Силіциди, тобто сполуки кремнію з різними металами, при дії води виділяють водневий кремній (силан), який самозаймається на повітрі:
Mg2Si + 4 H2O = 2Mg(OH)2 + SiH4 +646,5 кДж;
SiH4 + 2O2 = SiO2 + H2O + 1517 кДж.
Деякі металоорганічні сполуки реагують з водою, утворюючи горючі гази. Наприклад, диметілберілій при взаємодії з водою виділяє метан, а діетілмагній - етан.
Be(CH3)2 + 2H2O = Be(OH)2 + 2CH4;
Mg(C2H5)2 + H2O = MgO + 2C2H6.
Теплота, що виділяється при цьому, приводить до запалення газу, що виділяється, і вихідної речовини.
Деякі речовини при взаємодії з водою не утворюють горючі продукти, але теплота, що виділяється при реакції, розігріває ці речовини до високих температур, що сприяє виникненню горіння інших горючих матеріалів, які знаходяться поблизу зони реакції. До таких речовин відносяться оксиди і пероксиди металів, хлорид алюмінію, сірчана кислота, хлорсульфонова кислота та ін.
Реакція між хлоридом алюмінію і водою супроводжується утворенням негорючих продуктів – оксиду алюмінію та хлориду водню:
2AlCl3 + 3H2O = Al2O3 + 6HCl + 108,5 кДж.
При зрошенні водою концентрованої сірчаної кислоти виникає небезпека її розбризкування через сильний місцевий перегрів. Виділення великої кількості тепла (80 кДж моль–1) відбувається внаслідок утворення гідратів типу Н2SO4 xН2O.
Оксиди і пероксиди лужних металів взаємодіють з водою без виділення горючих газів. Наприклад, при взаємодії перекису натрію з водою утвориться перекис водню і гідрооксид натрію. В свою чергу перекис водню - нестійка сполука, яка здатна до самовільного розкладання з утворенням води і кисню також з виділенням теплоти.
Na2O2 +2H2O → 2NaOН + H2O2 +490,7 кДж;
H2O2 → H2O + 0,5O2 + 98,1 кДж.
Горіння може виникнути, якщо перекиси змішані чи стикаються з горючими речовинами.
Оксид кальцію (негашене вапно), реагуючи з невеликою кількістю води, розігрівається до світіння і може підпалити дотичні з ним горючі матеріали.
СаО + H2O = Са(ОН)2 + 65,3 кДж.
Деякі органічні речовини розчиняються в воді з виділенням великої кількості теплоти. Від теплоти реакції збільшується швидкість випаровування горючої рідини, що сприяє утворенню великого об’єму вибухонебезпечної суміші пари з повітрям.
