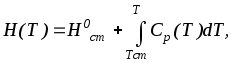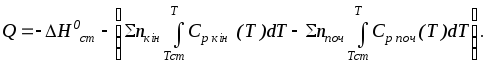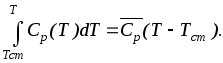- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
3.5 Горіння індивідуальних речовин в конденсованому стані
Для горючих речовин у рідкому або твердому агрегатному стані необхідно враховувати, що 1 кмоль важить кг ( – молярная маса пального, кг/кмоль). Отже кг горючої речовини для свого горіння потребує об’єм повітря теоретичний (n0п V п) м3 або дійсний об’єм (nп V п ) м3
1 кмоль ГР — n0п = 4,76∙ , кмолей повітря
кг ГР — n0п v п , м3 повітря
1 кг ГР — v0п , м3 повітря
Тоді питомі об’єми (на 1кг горючої речовини) повітря визначаються
питомий теоретичний об’єм повітря
|
v0п = 4,76∙ β∙v п /μ , м3/кг; |
(3.23) |
питомий дійсний об’єм повітря
|
vп =αп ∙4,76∙ β∙v п /μ , м3/кг. |
(3.24) |
Питомі об’єми (на 1кг горючої речовини) продуктів горіння визначаються так само із співвідношення:
1 кмоль ГР — n0ПГ = ∑nПГi , кмолей ПГ.
кг ГР — v ПГ∙∑nПГi , м3 ПГ.
1 кг ГР — v0ПГ , м3 ПГ.
Питомий теоретичний об’єм ПГ
|
v0ПГ = v ПГ/ ГР ∙ ∑nПГi , м3/кг; |
(3.25) |
Питомий дійсний об’єм ПГ
|
vПГ = v0ПГ+ (v ПГ/ ГР )∙(αп-1)∙4,76∙β , м3/кг. |
(3.25) |
При горінні будь-якої кількості mг.р. горючої речовини:
повний теоретичний об’єм повітря
|
v0п(повн) = v0п∙ mг.р., м3; |
(3.26) |
повний дійсний об’єм повітря
|
vп(повн) = vп∙ mг.р., м3; |
(3.27) |
повний теоретичний об’єм ПГ
|
v0ПГ(повн) = v0ПГ∙ mг.р., м3; |
(3.28) |
повний дійсний об’єм ПГ
|
vПГ(повн) = vПГ∙ mг.р., м3; |
(3.29) |
Висновок: Для індивідуальної речовини можна розрахувати кількість повітря та продуктів горіння на підставі рівняння реакції горіння та інформації про агрегатний стан реагентів.
3.6 Тепловий ефект хімічної реакції
Під тепловим ефектом реакції розуміють кількість теплоти, що виділяється чи поглинається системою при протіканні в ній необоротної хімічної реакції (хімічна енергія перетворюється в теплову) в умовах сталості температури і об’єму чи температури і тиску.
Енергетичний ефект хімічної реакції виникає за рахунок зміни в системі або внутрішньої енергії (при постійному об’ємі системи), або ентальпії (якщо тиск в системі не змінюється). Реакції горіння майже завжди протікають при постійному тиску, отже, їх тепловий ефект визначається зміною саме ентальпії системи.
Для виникнення хімічної реакції необхідна наявність певного теплового імпульсу, який має запас енергії, достатній для активації системи. Перехід системи із вихідного стану в кінцевий проходить через активні молекули, тобто початковій системі необхідно повідомити деяку кількість енергії – енергію активації Еакт. Для реакції горіння це енергія, яка йде на початковий розігрів горючої речовини та окислювача, і в більшості випадків підводиться до системи джерелом запалювання.
Між енергетичними характеристиками хімічної реакції - тепловим ефектом і енергіями активації прямої і зворотної реакцій - існує просте співвідношення. Його наочніше усього пояснити за допомогою рис. 3.1, на якому представлена потенційна енергія взаємодії атомів, що беруть участь у реакції, як функція так називаної “координати реакції”, що характеризує взаємне просторове положення атомів.

Рис. 3.1 – Залежність потенційної енергії взаємодії атомів, що беруть участь у реакції від «координати реакції»
Початковий і кінцевий рівні енергії відрізняються між собою на величину теплоти реакції Q.
|
Eкін – Eпоч = Q. |
(3.30 |
У тих випадках коли тепловміст системи після реакції зменшується, говорять про виділення енергії, тобто реакція екзотермічна. Коли тепловміст кінцевих продуктів більше, ніж вихідних, то реакція може протікати тільки при підводі енергії в систему, тобто вона ендотермічна. Реакції горіння є екзотермічними.
Можлива й інша ситуація, яка відповідає нестабільнім або, так званим, ендотермічним речовинам (рис. 3.2).

Рис. 3.2 – Залежність потенційної енергії взаємодії атомів, що беруть участь у реакції від «координати реакції» для ендотермічних речовин
При утворенні суміші таких речовин з окислювачем не потрібно початкового нагрівання, бо система сама переходить у більш енергетично вигідний стан.
Теплота утворення ендотермічних речовин має позитивний показник, тобто на їх утворення була витрачена енергія, і в результаті хімічної взаємодії з окислювачем накопичена енергія відразу виділяється у виді теплоти горіння. Прикладом таких речовин можуть служити діетилалюміній хлорид (С2Н5)2АlCl, tсс = – 53оС або триетилалюміній (С2Н5)3 Al , tсс = – 58оС.
Для визначення теплоти реакції застосуємо перший закон термодинаміки, відповідно до якого тепло, що виділилося в системі, дорівнює
|
- dQ = dU + PdV = dH – VdP |
(3.31) |
Якщо горіння відбувається при постійному тиску, тобто dP = 0, теплота реакції дорівнює різниці повних ентальпій системи в початковому і кінцевому стані.
|
Q = - ò dH = - D H . |
(3.32) |
Якщо ж згоряння відбулося в закритому об’ємі чи як при вибуху при незмінному об’ємі, то dV = 0, і теплота реакції виражається як
|
Q = - ò dU = - D U . |
(3.33) |
Оскільки в розглянутому процесі приріст тепла є повним термодинамічним диференціалом, то теплота реакції не залежить від шляху, по якому йде процес, а тільки від початкового і кінцевого стану системи (закон Гесса), отже, теплота реакції істотно залежить від того, у якому кінцевому стані взята речовина, наприклад вода у виді пари чи у виді рідини, вуглець у виді графіту чи алмазу (тобто від кристалічної структури) і т. п.
Розрахунок значно спрощується, якщо ввести поняття “абсолютна” внутрішня енергія і “абсолютна” ентальпія, але при введенні їх необхідно умовитися відносно початку шкали відліку енергії. У розрахунках термодинамічних величин як нульовий рівень енергії приймається нульовий рівень самої молекули даної речовини, і приріст внутрішньої енергії і ентальпії обчислюється при різних температурах стосовно цього рівня.
Для розрахунку абсолютної ентальпії речовин зручно користуватися стандартною теплотою утворення сполуки з простих речовин або теплотою згоряння.
Стандартна теплота утворення речовини - теплота реакції, у якій утвориться один моль речовини зі складових його елементів, що знаходилися в стандартних умовах (зазвичай Р = 101,3 кПа, Т = 298К).
Для оцінки стандартної теплоти утворення користаються значеннями енергій розриву хімічних зв'язків.
|
|
(3.34) |
де hfi - адитивний внесок зв'язку i - го типу, кДж/моль;
mi - кількість зв'язків i-го типу у молекулі.
Енергія розриву хімічного зв'язку (чи енергія зв'язку) - енергія, яку потрібно затратити, щоб відокремити друг від друга (розвести на велику відстань) два атоми (чи дві групи атомів), з'єднані цим зв'язком. Значення стандартних теплот утворення речовин приводяться в різноманітній довідковій літературі.
Стандартну теплоту реакції розраховують як різницю між стандартними теплотами утворення продуктів реакції і вихідних речовин.
Нехай в умовах постійного тиску прореагувала вихідна суміш, що містить nпоч молів вихідних речовин, що привело до утворення nкін молів продуктів реакції. Тому що повна ентальпія суміші газів дорівнює сумі тепловмісту всіх її компонентів, то для розглянутої реакції
|
Q = - (å nкін D Н0f кін - å nпоч D Н0f поч ), |
(3.35) |
де D H0f поч. , D H0f кін— молярні ентальпії утворення вихідних речовин і продуктів реакції.
Щоб розрахувати теплоту реакції, яка проходить в умовах, що відрізняються від стандартних, потрібно знайти зміну тепловмісту при переході до інших Р и Т. Залежність тепловмісту при постійному тиску від температури виражається формулою:
|
|
(3.36) |
де Нст – теплота реакції, що відбуває в стандартних умовах.
Тому теплота реакції, що відбуває при температурі Т, дорівнює:
|
|
(3.37) |
Однак, часто при наближених розрахунках теплоти реакції теплоємність вважають величиною, що не залежить від температури, і рівною деякому середньому її значенню в інтервалі температур від Тст. до Т.
|
|
(3.38) |
Тоді теплоту реакції, що протікає при постійному тиску і температурі Т, можна виразити:
|
|
(3.39) |