
- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
7.1 Загальні закономірності горіння газових сумішей
Горіння газів є гомогенним. В залежності від способу сумішоутворення розрізняють кінетичне та дифузійне горіння.
На пожежі в основному зустрічається горіння заздалегідь не змішаних газів. Компоненти реакції поступають в зону взаємодії з різних середовищ, кожне з яких містить тільки один з реагуючих компонентів. При цьому взаємодія можлива тільки після перенесення реагуючих компонентів за рахунок дифузії через кордон розділу обох середовищ в зону реакції. Швидкість постадійного процесу визначається швидкістю найповільнішого етапу.
Якщо швидкість перенесення речовини менше швидкості хімічної реакції, то швидкість горіння визначається лише швидкістю масообміну. У цьому випадку прийнято говорити, що реакція горіння протікає в дифузійній області. Швидкість взаємодії при цьому мало змінюється при підвищенні температури, так як швидкість дифузії порівняно слабо залежить від температури. При цьому поблизу кордону розділу один з реагуючих компонентів, який знаходиться в нестачі (по стехіометричному співвідношенню), витрачається практично повністю.
При горінні газу, який витікає в атмосферу повітря, кисень дифундує через шари продуктів горіння, поступає до зони горіння, де вступає в хімічну реакцію з пальним. Внаслідок дифузії окислювача з навколишнього середовища концентрація горючої речовини на деякій відстані від зрізу знизиться з 100% до певного співвідношення, при якому можливо протікання хімічної реакції, - до верхньої концентраційної межі. Через великий надлишок пального в цій області утворяться продукти неповного згоряння, а вуглець, що утворився в цій області зумовлює яскраво-жовте свічення дифузійного полум'я.
Такі закономірності характерні для дифузійного горіння.
Якщо вже є готова суміш, що складається з горючого газу і окислювача, то горіння класифікується як кінетичне. Само визначення "кінетичне горіння" введено внаслідок того, що швидкість процесу горіння залежить в основному від швидкості протікання хімічної реакції між горючою речовиною і окислювачем, і, отже, від кінетики відповідної реакції горіння. Швидкість кінетичного горіння сильно залежить від температури, при якій відбувається процес.
Процеси горіння заздалегідь змішаних газів називаються вибуховими. Так горіння в пальнику Бунзена являє собою стаціонарний вибух, процес самоспалахування - самовільний тепловий вибух. Найчастіше кінетичне горіння спостерігається при пожежах технологічного обладнання на стадії виникнення горіння (при самоспалахуванні або запалюванні), а також при поширенні горіння.
Кінетичне горіння - найбільш просте, яке піддається теоретичному аналізу, внаслідок чого воно є найбільш вивченим.
Внаслідок горіння утворюються гарячі продукти згоряння і відбувається їх теплове розширення. Якщо горіння відбувається в замкненому об'ємі або з великою швидкістю, то воно супроводжується підвищенням тиску
Стосовно до кінетичного горіння горючих сумішей в залежності від тиску продуктів горіння на практиці умовно розрізнюють такі види кінетичного горіння як "спалах", "хлопок" і "вибух".
Спалах – швидке згоряння газоповітряної суміші, яке відбувається в відкритому просторі, збільшення тиску продуктів згоряння при цьому не відбувається.
Хлопок – швидке згоряння газоповітряної суміші, яке відбувається в закритому просторі, супроводжується незначним підвищення тиску, яке викликає лише звукові ефекти, але руйнування конструкцій при цьому не спостерігається.
Вибух – це швидке екзотермічне згоряння, що супроводжується різким виділенням значної кількості енергії і утворенням стислих газів, здатних виконувати роботу.
Вибух відрізняється більшою швидкістю поширення фронту полум'я і різкою зміною тиску, яка може стати причиною руйнування технологічного обладнання і будівельних конструкцій.
Тиск при вибуху можна оцінити, використовуючи рівняння стану ідеального газу для початкової суміші і для продуктів горіння:
PoVo =ΣnпочRTo PвибVвиб =ΣnпгRTвиб
де То, Ро, Vo - початкові температура, тиск і об'єм горючої суміші;
Твиб, Рвиб, Vвиб - температура, тиск і об'єм продуктів горіння;
Σnпоч. - число молів початкової суміші, моль;
Σnпг - число молів продуктів горіння, моль;
R - універсальна газова стала.
Оскільки згоряння горючої суміші за рахунок великої швидкості реакції відбувається без теплового розширення і, отже, без зміни об'єму середовища, то для розрахунку тиску при вибуху можна використати формулу:-2
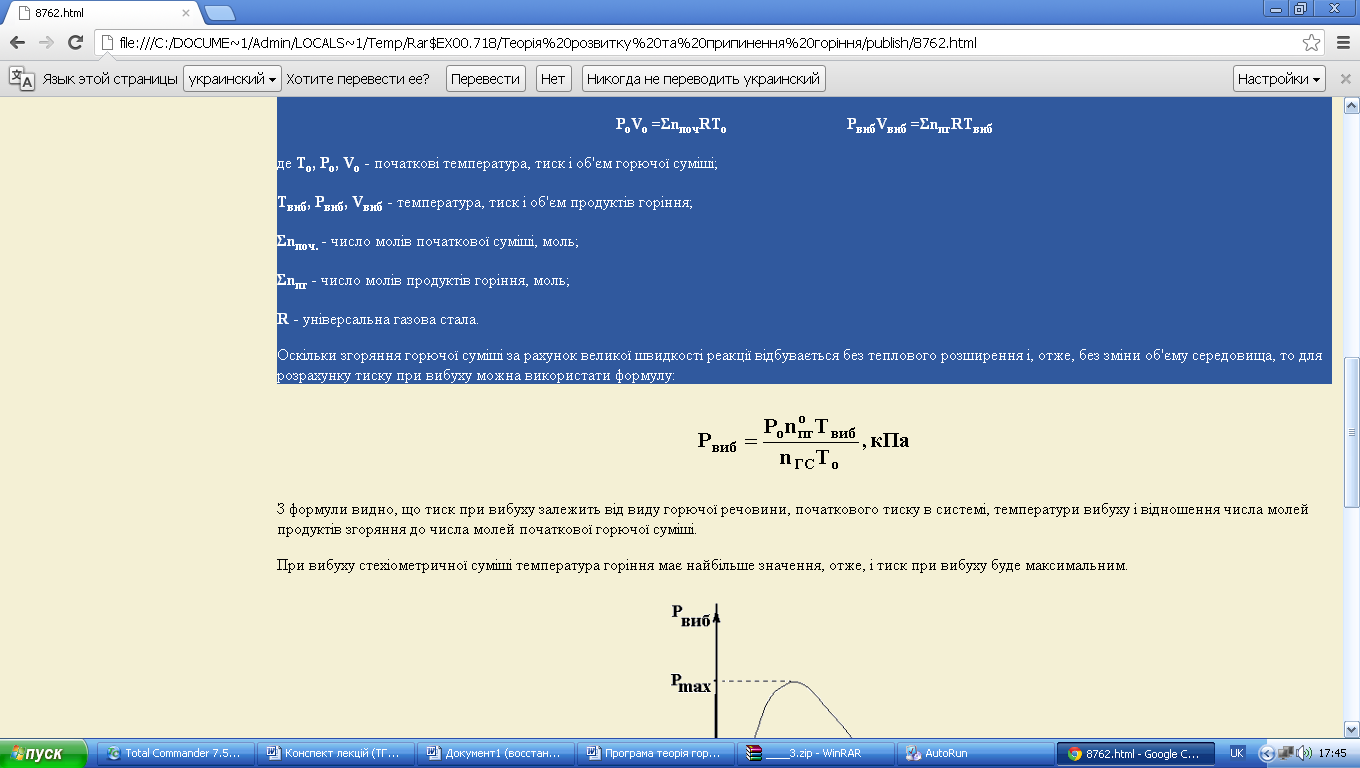
З формули видно, що тиск при вибуху залежить від виду горючої речовини, початкового тиску в системі, температури вибуху і відношення числа молей продуктів згоряння до числа молей початкової горючої суміші.
При вибуху стехіометричної суміші температура горіння має найбільше значення, отже, і тиск при вибуху буде максимальним (рис. 7.1).

Рис. 7.1
Зниження або підвищення концентрації горючої речовини приведе до наявності надлишку газу, який не бере участі в хімічній реакції, за рахунок цього до збільшення тепловтрат і зниження температури горіння. Тиск при вибуху при цьому також знизиться.
При заміні повітря в горючій суміші киснем тиск при вибуху різко збільшиться, так як знижується кількість молей початкової суміші (1моль ГР + b молів кисню замість 1моль ГР + 4,76b молів повітря), при цьому збільшується температура горіння (не тратиться значна кількість тепла на нагрівання азоту, присутнього в повітрі). Так при горінні стехіометричної суміші метану з киснем тиск, що утворюється при вибуху, збільшується майже в 2 рази в порівнянні з газоповітряною сумішшю.
Для того щоб розрахунковим способом визначити тиск при вибуху, необхідно знати температуру вибуху. Визначити температуру вибуху можна методом лінійної інтерполяції (також як і температуру горіння речовини). Оскільки горіння при вибуху відбувається дуже швидко, і гази, що утворилися не встигають розширитися, то з курсу термодинаміки Ви знаєте, що такий процес називається адіабатним і ізохорним, тобто без тепловтрат в довкілля і при постійному об'ємі. Згідно з першим законом термодинаміки зміна ентальпії системи рівна:
Н = U + PV; PV = nRT.
Внутрішня енергія продуктів горіння при певній температурі Т буде рівна:
UТ = Σ(HiT nпг i) - RT Σnпг i,
Енергія вибуху – це зміна внутрішньої енергії системи між кінцевим і початковим станом.
Qвиб. = (Uпг – Uпоч)
Після нескладних перетворень можна отримати вираження:
Qвиб. = Qн + RTo Δn
Тоді температуру вибуху можна розрахувати по формулі:
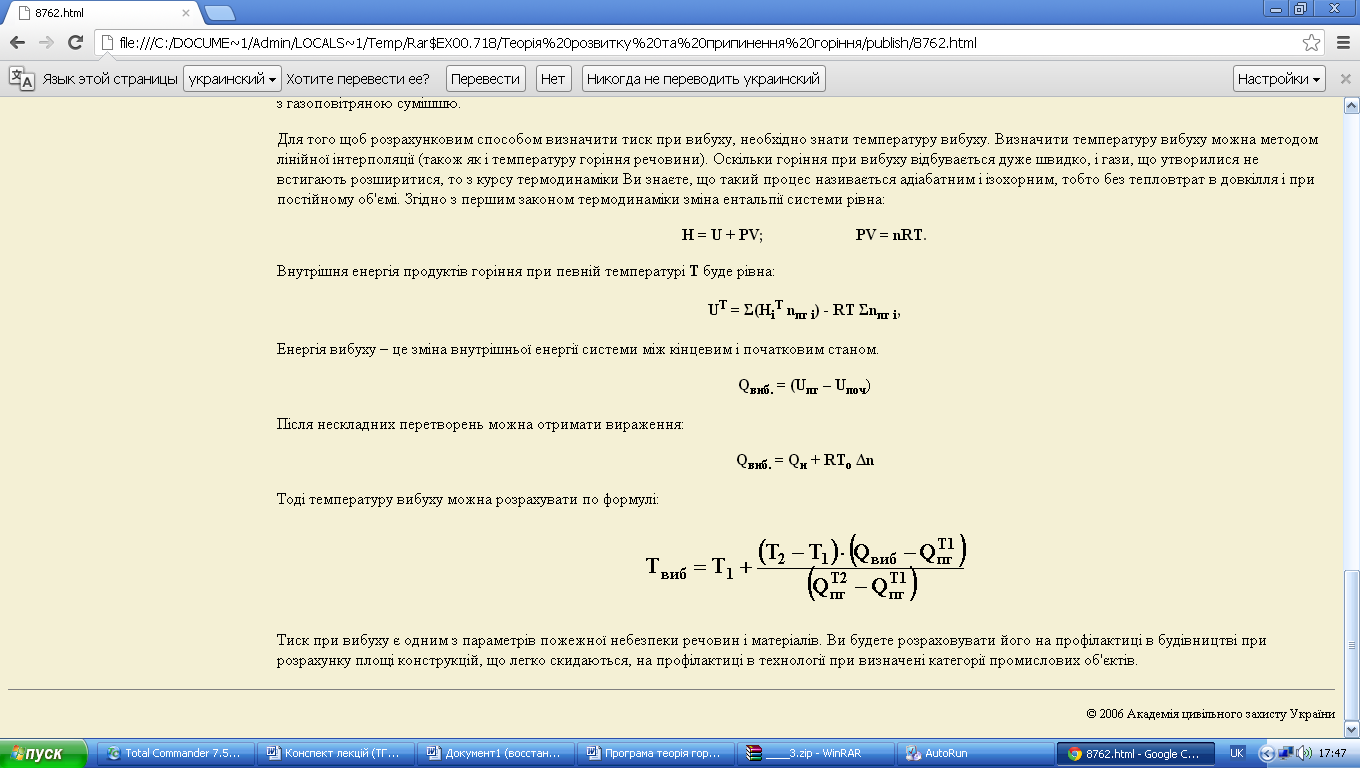
Тиск при вибуху є одним з параметрів пожежної небезпеки речовин і матеріалів. Ви будете розраховувати його на профілактиці в будівництві при розрахунку площі конструкцій, що легко скидаються, на профілактиці в технології при визначені категорії промислових об'єктів.
