
- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
2.1. Ланцюгові реакції
Ланцюгові реакції на відміну від звичайних хімічних перетворень характеризуються виникненням в кожному елементарному акті активної частинки: атома, що володіє неспареним електроном, вільного радикала або іона. Появу активних частинок викликає ланцюг перетворень початкових речовин в продукти реакції. Атоми, вільні радикали і іони більш реакционноспособны, ніж валентнонасыщенные молекули. Тому, не дивлячись на значні витрати енергії, необхідні для розриву хімічних зв'язків і утворення активних частинок, ланцюговий розвиток реакції часто виявляється енергетично вигідніше, ніж безпосередня взаємодія між молекулами.
Процеси горіння в основному протікають по ланцюговому механізму. Ланцюгові реакції - складні реакції, що протікають в декілька стадій, що є:
зародження ланцюгів (ініціація), при якому утворюються активні частинки;
продовження ланцюгів, при якій активні частинки вступають в хімічну взаємодію з початковими речовинами, внаслідок чого утворюються нові активні частинки;
обрив ланцюгів, при якому відбувається «загибель» активних частинок з утворенням кінцевих продуктів реакції
Зародження ланцюгів може відбуватися за різних умов. Наприклад, в результаті дисоціації молекул під дією теплової енергії, або іонізуючих випромінювань, в електричному розряді. Загибель активних частинок відбувається при їх рекомбінації*, при взаємодії вільних радикалів (гомогенний обрив ланцюгів), при взаємодії активних частинок з твердими поверхнями (гетерогенний обрив ланцюгів) або в результаті їх реакції з інгібіторами горіння.
Існують нерозгалужені і розгалужені ланцюгові реакції. У нерозгалужених на кожну активну частинку, витрачену в реакціях продовження ланцюга, доводиться одна що знов виникає. Число молекул продуктів, що утворилися, на одну початкову активну частинку називається довжиною ланцюга. Довжина ланцюгів в реакціях горіння коливається від сотень тисяч до десятків мільйонів. На швидкість нерозгалужених ланцюгових реакцій можуть впливати незначні домішки речовин, здатні ефективно взаємодіяти з активними частинками - інгібіторами горіння.
Деякі речовини - ініціатори - полегшують утворення активних частинок і тим самим прискорюють нерозгалужені ланцюгові реакції.
У розгалужених ланцюгових реакціях на одну активну частинку, що витрачається при продовженні ланцюга, утворюються дві або активніші частинки. Одна з них продовжує первинний ланцюг, а інші починають нові ланцюги, утворюючи розгалуження.
Рекомбінація - процес утворення нейтральних атомів або молекул із заряджених частинок. Атоми, що утворюються при рекомбінації, і молекули можуть знаходитися в основному або збудженому стані

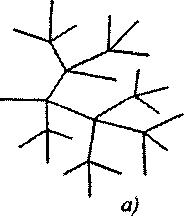
а) б)
Рис. 2.1 - Схематичне зображення реакційних ланцюгів:
а) розгалуження в кожній ланці ланцюга; 6) рідкісне розгалуження
Наприклад, при горінні водню в реакції зародження ланцюга:
![]()
утворюється
активний атом
![]() .
У реакції продовження ланцюга:
.
У реакції продовження ланцюга:
У реакції продовження ланцюга:

відбувається збільшення числа активних атомів, нових ланцюгів, що є початком.
Розгалужені ланцюгові реакції можуть протікати в стаціонарному режимі, при якому швидкість розгалуження менше швидкості загибелі активних частинок, і в нестаціонарному, при якому загибель відбувається повільніше, ніж розгалуження. У останньому випадку швидкість ланцюгової реакції зростає по експоненціальному закону і лімітується тільки витрачанням початкових речовин. Перехід від стаціонарного до нестаціонарного режиму відбувається стрибкоподібно при незначній зміні умов протікання реакції: температури, тиск або концентрації однієї з реагуючих речовин. Таке швидке прискорення розглядається як самозаймання реакційної суміші або ланцюговий вибух.
Відкриття розгалужених ланцюгових реакцій мало величезне значення для створення теорії процесів горіння. Доведено, що існує два типи займання: теплове і ланцюгове. Закономірності, встановлені в
теорії ланцюгових процесів, дозволяють ефективно впливати на розвиток і придушення процесів горіння при пожежах.
