
- •Міністерство освіти і науки, молоді та спорту україни
- •1. За агрегатним станом компонентів горючої суміші в зоні горіння.
- •2. За способом утворення горючої суміші.
- •3. За механізмом поширення горіння.
- •4. За газодинамічним режимом горіння
- •Методика складання рівнянь реакції горіння.
- •2.1. Ланцюгові реакції
- •2.2. Зародження ланцюгів
- •2.3 Продовження ланцюгів
- •2.4 Хімічні процеси при горінні водню
- •3.1 Визначення матеріального балансу
- •3.2 Витрата повітря на горіння
- •3.5 Горіння індивідуальних речовин в конденсованому стані
- •3.7 Теплота згоряння. Види теплоти згоряння
- •1) Вид горючої речовини:
- •2) Склад горючої суміші:
- •3) Умови, в яких знаходиться горюча суміш:
- •4.1. Визначення полум'я та структура полум'я
- •4.2.Концентраційні межі поширення полум'я
- •4.2.1. Поняття концентраційних меж поширення полум'я
- •4.2.2. Метод визначення концентраційних меж поширення полум'я
- •4.2.3 Чинники, що впливають на концентраційні межі
- •4.2.4. Практичне значення концентраційних меж поширення полум'я
- •5.1 Види виникнення горіння
- •5.2 Теплова теорія само спалахування
- •5.3 Температура самоспалахування речовин
- •5.4 Фактори, що впливають на температуру самоспалахування
- •1) Вид горючої речовини,
- •2) Склад горючої суміші,
- •3) Умови, в яких знаходиться горюча суміш.
- •5.5 Визначення температури самоспалахування а її практичне значення
- •5.6 Класифікація процесів самозаймання. Відмінні особливості самозаймання
- •5.7 Умови, які необхідні для виникнення самозаймання.
- •5.8. Різні види самозаймання теплове самозаймання
- •Хімічне самозаймання
- •Самозаймання речовин при контакті з хімічними окислювачами.
- •Фізичне самозаймання
- •1.1. Механізм фізичного самозаймання вугілля
- •Мікробіологічне самозаймання
- •6.1 Поняття і особливості процесу запалювання
- •6.2 Ініціювання горіння в холодному газі нагрітими тілами
- •6.3 Чинники, що впливають на процес запалювання
- •6.4 Запалювання горючих систем електричними розрядами
- •Τ охол 3 τ хр
- •6.5 Підпалення фрикційними іскрами, краплями розплавленого металу
- •7.1 Загальні закономірності горіння газових сумішей
- •7.2 Закономірності поширення кінетичного горіння в газових сумішах
- •8.1 Загальні закономірності випаровування та горіння рідин
- •8.2 Температурні межі поширення полум'я
- •8.3 Класифікація твердих горючих матеріалів
- •8.4 Загальні закономірності горіння твердих речовин
- •Сргаз(Тзап - Tкип,(розкл))]
- •8.5 Особливості горіння металів
- •8.6 Загальна характеристика і властивості пилу
- •8.7 Запалювання дисперсних систем
- •8.8 Особливості горіння пилу в стані аерозоль та аерогель
- •9.2 Критичний час розвитку пожежі в огорожі.
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі.
- •9.1 Динаміка розвитку пожежі в огорожі
- •9.2 Критичний час розвитку пожежі в огорожі
- •9.3 Основні положення інтегральної моделі температурного режиму
- •Фактори, що впливають на температуру пожежі в огородженні
- •9.5 Основні положення зонної моделі температурного режиму
- •Основні закономірності газообміну при пожежі в огородженні
- •9.6 Визначення висоти нейтральної зони. Методи регулювання газообміну на пожежі
- •10.1. Роль концентраційних меж поширеня полум'я у погасанні полум'я
- •10. 2 Погасання полум'я у вузьких каналах
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •11. 1 Методи та способи припинення горіння
- •Припинення горіння
- •11.2 Запобігання виникнення горючого середовища
- •11.2 Запобігання виникнення горючого середовища та джерел запалювання в ньому
- •11.3 Поняття та загальні вимоги до вогнегасних речовин
- •1. Охолодження
- •2. Розбавлення
- •3. Ізоляція
- •4. Хімічне гальмування реакції горіння
- •11.4 Механізм припинення горіння охолодженням
- •Теоретична інтенсивність подачі води на гасіння пожежі
- •Qпогл q відв
- •Методи підвищення вогнегасної ефективності води на пожежі
- •11.5 Основи припинення горіння ізоляцією, інгібіруванням, розбавленням.
- •Механізм припинення горіння методом розбавлення
- •Список джерел
3. За механізмом поширення горіння.
Після виникнення горіння фронт полум’я, або зона хімічної реакції, починає поширюватися по горючій системі. Залежно від механізму поширення горіння по горючій суміші розрізняють два характерних режими горіння: дефлаграційне та детонаційне.
При відносно невеликих швидкостях (порівняно повільне поширення зони хімічних реакцій, зі швидкістю руху по горючій суміші від 0,5 до 50 м/с) відбувається пошарове запалення холодної газової суміші за рахунок її нагріву від зони горіння. Це тепло і є причиною безупинного підтримання процесу горіння. передача імпульсу горіння відбувається теплопровідністю. Такий механізм називається дефлаграцією.
Але існує і інший механізм поширення горіння – за рахунок швидкого адіабатичного стиснення. Такий механізм горіння називається детонацією.
Детонація може виникнути у вибуховому середовищі у разі його попереднього швидкого стиснення сильною ударною хвилею. Таку хвилю може створити зовнішній імпульс (наприклад згоряння вибухової речовини). Характерною особливістю ударного стиснення є нагрівання газу (до 1500-1700К). Вибухове середовище, нагріте сильною ударною хвилею до такої температури, спалахує. Самовільне виникнення детонації в газі, що горить, можливо при достатній швидкості поширення горіння - більше за 500 м/с, в той час як нормальна швидкість горіння не перевищує 10 м/с.
В умовах звичайної пожежі горіння протікає частіше в дефлаграциійному режимі. Детонаційне горіння у вигляді вибуху горючих газових сумішей зустрічається надзвичайно рідко. Воно характерно для вибухів метано - пило повітряних сумішей вугільних шахт.
Знання особливостей і різновидів процесів горіння, а також умов переходу гомогенного горіння в гетерогенне, дифузійного в кінетичне та навпаки, дозволяє запобігати таким небезпечним явищам на пожежі як вибухи.
4. За газодинамічним режимом горіння
Важливою характеристикою гомогенного горіння є газодинамічний стан компонентів горючої суміші в зоні реакції. Процес горіння характеризується інтенсивністю надходження компонентів горючої суміші в зону реакції.
Якщо компоненти горючої суміші надходять до зони реакції повільно, по законах молекулярної або слабкої конвекційної дифузії, то процес горіння вважається ламінарним.
Якщо потоки горючого газу та окислювача або готової горючої суміші надходять інтенсивно, то режим горіння буде турбулентним, тобто з інтенсивними завихреннями, перемішуванням продуктів горіння з вихідною сумішшю, відривами зони горіння від основного факелу полум’я.
Параметром, що характеризує газодинамічний режим горіння є числове значення критерію Рейнольдса. Якщо Re < 2300 , то полум’я відноситься до ламінарного, якщо 2300 < Re < 10 000 – полум’я перехідне, якщо Re > 10 000 – турбулентне.
Таким чином, процес горіння на пожежі можна характеризувати по природі хімічних реакцій як гомогенне на початку розвитку пожежі та гетерогенне або змішане під час догоряння, по кінетичним параметрам як кінетичне під час виникнення горіння та дифузійне в процесі вигоряння горючих речовин, по механізму поширення зони хімічної реакції як дефлаграційне та по газодинамічним параметрам режиму горіння як турбулентне.
1.3 Особливості складання рівнянь реакцій горіння
Будь-яке горіння супроводжується утворенням великої кількості тепла та продуктів горіння. Саме ці явища обумовлюють всі особливості протікання пожежі. Для визначення основних параметрів процесу горіння, а саме кількості тепла, що виділяється при горінні, та об'єму продуктів горіння необхідно вміти складати рівняння реакції горіння
На більшості пожеж окислювачем виступає кисень повітря. Але кисень до зони горіння надходить не в чистому вигляді, а разом з іншими компонентами повітря.
Склад повітря:
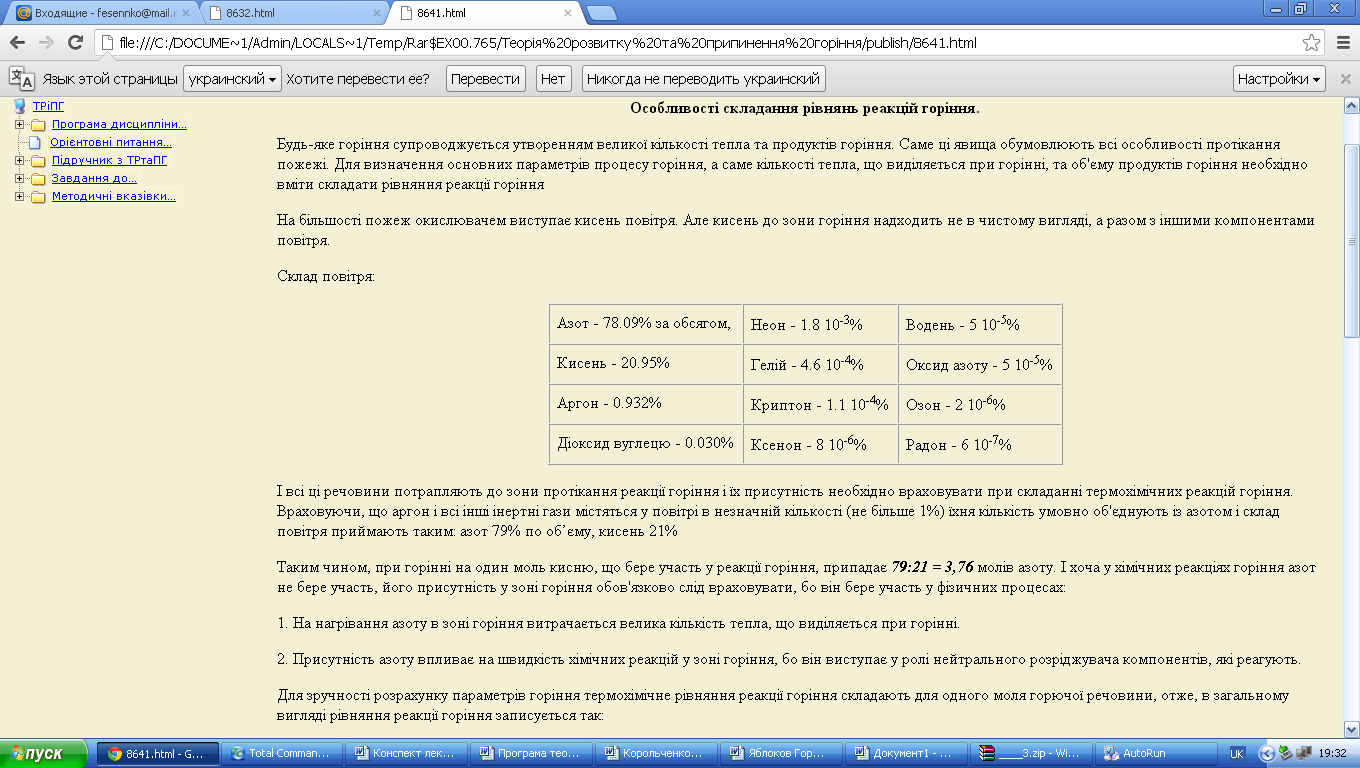
І всі ці речовини потрапляють до зони протікання реакції горіння і їх присутність необхідно враховувати при складанні термохімічних реакцій горіння. Враховуючи, що аргон і всі інші інертні гази містяться у повітрі в незначній кількості (не більше 1%) їхня кількість умовно об'єднують із азотом і склад повітря приймають таким: азот 79% по об’єму, кисень 21%
Таким чином, при горінні на один моль кисню, що бере участь у реакції горіння, припадає 79:21 = 3,76 молів азоту. І хоча у хімічних реакціях горіння азот не бере участь, його присутність у зоні горіння обов'язково слід враховувати, бо він бере участь у фізичних процесах:
1. На нагрівання азоту в зоні горіння витрачається велика кількість тепла, що виділяється при горінні.
2. Присутність азоту впливає на швидкість хімічних реакцій у зоні горіння, бо він виступає у ролі нейтрального розріджувача компонентів, які реагують.
Для зручності розрахунку параметрів горіння термохімічне рівняння реакції горіння складають для одного моля горючої речовини, отже, в загальному вигляді рівняння реакції горіння записується так:
Горюча речовина + β(О2 + 3,76 N2) = Σ Продуктів горіння – ΔH
де β- стехіометричний коефіцієнт, що показує числомолів повітря, необхідне для повного згоряння 1 молю горючої речовини.
