
- •0Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Визначення карбонатної твердості води
Мета роботи – освоєння методики визначення тимчасової твердості води.
Загальні вказівки
Починаючи виконувати роботу,
необхідно знати, що однією з найважливіших
характеристик природних вод є їхня
твердість, яка обумовлена вмістом у них
іонів
![]() і
і
![]() .
.
Залежно від того, до складу
яких солей входять іони
![]() і
і
![]() ,
розрізняють твердість карбонатну або
тимчасову (
,
розрізняють твердість карбонатну або
тимчасову (![]() і
і
![]() )
і некарбонатну або постійну (
)
і некарбонатну або постійну (![]() ).
Вимірюють твердість води кількістю
мілімоль еквівалентів (ммоль е) катіонів
).
Вимірюють твердість води кількістю
мілімоль еквівалентів (ммоль е) катіонів
![]() і
і
![]() або відповідних солей в 1 л води.
або відповідних солей в 1 л води.
При розрахунках, пов’язанихз твердістю води, необхідно враховувати, що
![]() і
і
![]()
 (г/моль)
(г/моль)
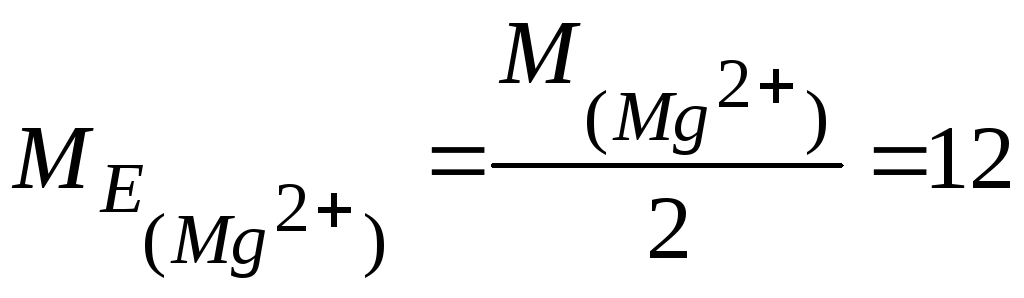 (г/моль)
(г/моль)
Визначення тимчасової
твердості води зводиться до визначення
концентрації гідрокарбонат-іонів
![]() і тим самим до еквівалентної цим іонам
концентрації іонів твердості
і тим самим до еквівалентної цим іонам
концентрації іонів твердості
![]() і
і
![]() .
.
Необхідно враховувати, що
аніон
![]() у воді гідролізує, в результаті чого
вода має лужне середовище:
у воді гідролізує, в результаті чого
вода має лужне середовище:
![]()
або в молекулярному вигляді:
![]() (1)
(1)
Саме тому карбонатну твердість визначають методом титрування проби води соляною кислотою в присутності індикатора метилоранжу до переходу жовтого кольору індикатора (характерного для лужного середовища) в рожевий.
При титруванні такої води розчином соляної кислоти відбувається реакція нейтралізації:
![]()
або
![]() (2)
(2)
Склавши рівняння 1 і 2, одержимо рівняння реакції, яка відбувається при визначенні тимчасової твердості води за допомогою розчину соляної кислоти:
![]()
Порядок виконання роботи
У конічну колбу за допомогою циліндра відміряти 100 мл води, що досліджується, додати 1–2 краплі метилоранжу. Приготовану пробу відтитрувати 0,1н розчином соляної кислоти до переходу жовтого кольору індикатора в рожевий. Визначити об’єм кислоти, який пішов на титрування. Титрування повторити три рази (результати титрування не повинні розбігатися більш як на 0,1 мл). Знайти середнє значення об’єму розчину кислоти, яка пішла на титрування води.
Оформлення результатів роботи
Результати титрування записати в таблицю:
|
Номер проби |
Об’єм води, мл |
Об’єм кислоти, мл |
Нормальність кислоти |
Розрахувати твердість води
(![]() )
за формулою:
)
за формулою:
![]() ,
,
де
![]() - середній об’єм розчину
соляної кислоти, який пішов на титрування,
- середній об’єм розчину
соляної кислоти, який пішов на титрування,
мл;
![]() - нормальність розчину соляної
кислоти, моль/л;
- нормальність розчину соляної
кислоти, моль/л;
![]() - об’єм води,
який взяли для титрування.
- об’єм води,
який взяли для титрування.
Питання для самоперевірки
1. Наявність яких сполук обумовлює твердість води?
2. Які солі обумовлюють карбонатну, а які некарбонатну твердість води?
3. У яких одиницях вимірюється твердість води?
4. У чому полягає метод визначення карбонатної твердості води?
5. Чому вода, що містить солі карбонатної твердості, має лужне середовище?
6. Якими засобами можна усунути твердість води?
Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
Мета роботи - визначення кількості вільного і зв’язаного діоксиду вуглецю в пробах води і розрахування (на основі одержаних результатів) кількості агресивного діоксиду вуглецю у воді.
Загальні вказівки
Треба знати, що діоксид
вуглецю, звичайно, присутній в усіх
природних водах у двох формах: вільний
діоксид вуглецю розчинений у воді і
зв’язаний (діоксид вуглецю, який входить
до складу гідрокарбонат-іонів
![]() і карбонат-іонів
і карбонат-іонів
![]() ).
).
Саме наявність діоксиду вуглецю у воді в основному зумовлює корозійні властивості води по відношенню до вапнякових і бетонних споруд. Між різними формами вугільної кислоти у водних розчинах існує динамічна карбонатна рівновага:
![]()
Оскільки дисоціація вугільної кислоти за другим ступенем незначна, то основна карбонатна рівновага природних вод є системою з вільної кислоти і гідрокарбонат-іонів:
![]()
Необхідно звернути увагу на
той факт, що практично нерозчинний у
воді карбонат кальцію
![]() може взаємодіяти з розчиненим у воді
діоксидом вуглецю
може взаємодіяти з розчиненим у воді
діоксидом вуглецю
![]() ,
перетворюючись у добре розчинний
гідрокарбонат кальцію
,
перетворюючись у добре розчинний
гідрокарбонат кальцію
![]() ,
і тим самим спричиняти вуглекислотну
корозію бетонних і вапнякових споруд:
,
і тим самим спричиняти вуглекислотну
корозію бетонних і вапнякових споруд:
![]() .
.
тв. речов. розчин
Константа цієї рівноваги має вигляд:

Враховуючи сталість концентрацій
![]() і
і
![]() вона перетворюється у константу
карбонатної рівноваги:
вона перетворюється у константу
карбонатної рівноваги:

Та частина вільного діоксиду вуглецю, яка входить у вираз константи карбонатної рівноваги і підтримує рівновагу між карбонатами та гідрокарбонатами, безпечна для будівельних споруд і називається рівноважним або інактивним діоксидом вуглецю. Вуглекислотну корозію будівельних споруд викликає надлишок вільного діоксиду вуглецю над рівноважним (так званий агресивний діоксид вуглецю), який за величиною дорівнює різниці між вільним діоксидом вуглецю, що знаходиться у воді, та рівноважним діоксидом вуглецю.
Порядок виконання роботи
Дослід 1. Визначення вільного діоксиду вуглецю.
Відібрати піпеткою 100 мл води і перенести в конічну колбу, додати 2-3 краплі фенолфталеїну та відтитрувати 0,1 н розчином їдкого натру при постійному перемішуванні до появи блідо-рожевого забарвлення, яке не зникає на протязі 1 хв. Визначити об’єм лугу, витраченого на титрування. Титрування повторити тричі.
Дослід 2. Визначення зв’язаного діоксиду вуглецю.
Відібрати піпеткою 100 мл води і перенести в конічну колбу. Додати 2-3 краплі метилоранжу і відтитрувати 0,1 н розчином соляної кислоти при постійному перемішуванні до переходу блідо-жовтого забарвлення в блідо-рожеве. Визначити об’єм кислоти, витраченої на титрування. Титрування повторити тричі.
Оформлення результатів роботи
Дослід 1. Результати, одержані при титруванні, записати в таблицю:
|
Номер проби |
Об’єм води, мл
|
Об’єм
|
Нормальність
|
Знайти середнє значення об’єму розчину лугу, витраченого на титрування.
Написати рівняння реакції, що відбувається при титруванні розчином лугу води, яка вміщує вільний діоксид вуглецю. Масу вільного діоксиду вуглецю (мг/л) розрахувати за формулою:
![]()
де
![]() - об’єм води, який взяли
для титрування, мл;
- об’єм води, який взяли
для титрування, мл;
![]() -
середній об’єм лугу,
витраченого на титрування, мл;
-
середній об’єм лугу,
витраченого на титрування, мл;
![]() - нормальність розчину лугу,
моль/л;
- нормальність розчину лугу,
моль/л;
44 – молярна маса еквівалента вільного діоксиду вуглецю в реакції утворення кислої солі, г/моль.
Дослід 2. Результати, одержані при титруванні, записати в таблицю:
|
Номер проби |
Об’єм води, мл |
Об’єм
|
Нормальність
|
Знайти середнє значення об’єму кислоти, витраченої на титрування. Написати рівняння реакції, яка відбувається при титруванні води, в якій містяться гідрокарбонат-іони, розчином соляної кислоти.
Масу зв’язаного діоксиду вуглецю (мг/л) розрахувати за формулою:
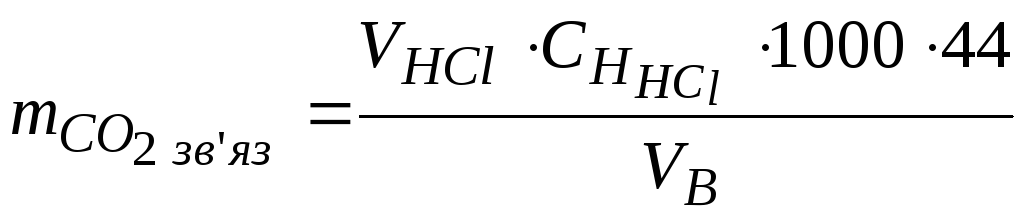 ,
,
де
![]() - об’єм води, який взяли
для титрування, мл;
- об’єм води, який взяли
для титрування, мл;
![]() - середній об’єм
кислоти, який пішов на титрування, мл;
- середній об’єм
кислоти, який пішов на титрування, мл;
![]() - нормальність кислоти, моль/л;
- нормальність кислоти, моль/л;
44 – молярна маса еквівалента зв’язаного діоксиду вуглецю в даній реакції, г/моль.
Кількість агресивного діоксиду вуглецю розрахувати на основі результатів визначення кількості вільного і зв’язаного діоксиду вуглецю, використовуючи таблицю Леманна і Реуса.
Знайти величину А за формулою:
![]()
У таблиці Леманна і Реуса за величиною А знайти відповідну їй величину Б і далі з формули:
![]()
знайти кількість агресивного діоксиду вуглецю (мг/л).
Питання для самоперевірки
1. У яких формах присутній в природних водах діоксид вуглецю?
2. Що таке карбонатна рівновага?
3. Який діоксид вуглецю називається рівноважним, а який агресивним?
4. Який діоксид вуглецю спричиняє вуглекислотну корозію бетону?
У чому полягає метод визначення агресивного діоксиду вуглецю?
Лабораторна робота № 20
