
- •0Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Корозія металів
Мета роботи- ознайомлення з корозією металів і засобами захисту від неї.
Загальні вказівки
Необхідно чітко уявляти, що корозія металів є гетерогенним процесом, в якому хімічні та електрохімічні процеси відбуваються на межі поділу двох фаз – метал і зовнішнє середовище, причому метал переходить в іонний (окиснений) стан.
Особливу увагу необхідно звернути на електрохімічну корозію, яка відбувається в середовищі електроліту і супроводжується виникненням у системі електричного струму.
Дуже важливо зрозуміти, що при електрохімічній корозії руйнування металу відбувається внаслідок роботи багатьох мікрогальванічних елементів – гальванопар, які утворюються через різницю потенціалів на різних ділянках поверхні металу. Причиною різниці потенціалів можуть бути контакт двох різних металів, наявність домішок у металі, структурна неоднорідність металу та ін. При цьому треба пам’ятати, що анодними є ділянки металу, які мають менше значення електродного потенціалу. На анодних ділянках метал окиснюється, іони металу переходять у розчин і гідратуються, звільняючи зайві електрони, які, залишившись на металі, рухаються до катодної ділянки. На катодних ділянках поверхні металу зайві електрони поглинаються окисником.
Залежно від реакції середовища окисниками при корозії можуть бути іони водню електроліту або розчинений в електроліті кисень повітря. Для прикладу розглянемо корозію заліза, яке має домішки міді, у кислому середовищі (рис.6)

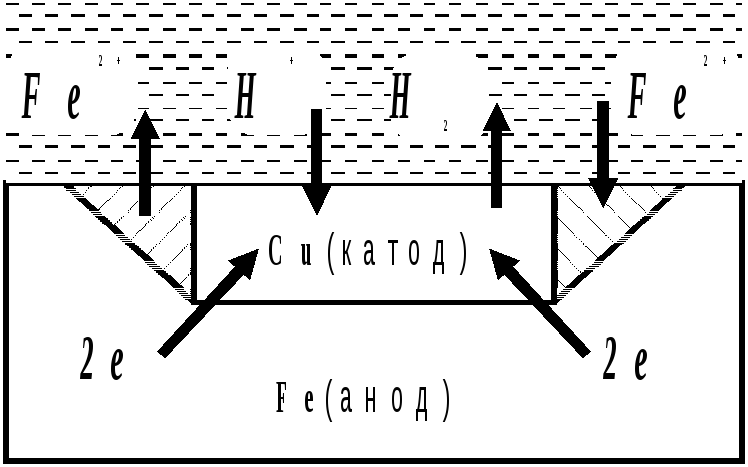
Рис. 6 Схема електрохімічної корозії заліза при рН< 7
У результаті залізо руйнується в місці контакту, а на міді виділяється водень.
У нейтральному й лужному
середовищах (![]() )
процес корозії виражається рівняннями:
)
процес корозії виражається рівняннями:
![]() (на аноді)
(на аноді)
![]() (на катоді)
(на катоді)
![]() (у розчині)
(у розчині)
Під впливом кисню повітря
окиснення
![]() відбувається далі за рівнянням реакції:
відбувається далі за рівнянням реакції:
![]()
Порядок виконання роботи
Дослід 1. Вплив контакту металів на розчинення їх у кислотах.
1. Налити в пробірку 5-6 мл 10% розчину сірчаної кислоти, вкинути туди шматочок гранульованого цинку (чистого). Відзначити, як швидко відбувається взаємодія цинку з кислотою (за швидкістю виділення бульбашок водню). Занурити в розчин мідну дротинку, доторкнутися нею до цинку. Спостерігати, як змінюється швидкість виділення водню. На якому з металів у даному випадку виділяється водень?
Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
1. Попередні випробування на
іон
![]() .
.
У результаті електрохімічної
корозії заліза в розчин переходять іони
![]() ,
які можна виявити за допомогою
гексаціаноферату(III)
калію
,
які можна виявити за допомогою
гексаціаноферату(III)
калію
![]() ,
який утворює з цими іонами комплексну
сполуку
,
який утворює з цими іонами комплексну
сполуку
![]() інтенсивно синього кольору під назвою
“турнбулева синь”. Поява цього кольору
свідчить про наявність іонів заліза
інтенсивно синього кольору під назвою
“турнбулева синь”. Поява цього кольору
свідчить про наявність іонів заліза
![]() у розчині і, отже, про корозію заліза.
у розчині і, отже, про корозію заліза.
Налити в пробірку декілька
мл розведеного розчину
![]() і додати декілька крапель розчину
гексаціаноферату(III)
калію. Спостерігати забарвлення розчину
в синій колір.
і додати декілька крапель розчину
гексаціаноферату(III)
калію. Спостерігати забарвлення розчину
в синій колір.
2. У дві пробірки налити по 2-3 мл розбавленої сірчаної кислоти і додати по 2-3 краплі гексаціаноферату(III) калію. Узяти дві залізні канцелярські скріпки, затиснути в одну з них шматочок цинку, в іншу – олова і занурити в приготовлені пробірки. Через 5 хвилин відзначити змінення кольору розчину.
Дослід 3. Гальмування корозії за допомогою інгібіторів.
У дві пробірки налити по 2-3 мл 1 н розчину соляної кислоти і внести по шматочку цинку. Коли виділення водню стане досить інтенсивним (якщо реакція проходить повільно, підігріти пробірки) додати в одну з них на кінці шпателя уротропін. Як змінилась інтенсивність виділення водню?
Оформлення результатів роботи
Дослід 1.Скласти рівняння реакції взаємодії цинку з розчином сірчаної кислоти в молекулярній та іонній формі, скласти схему гальванопари цинк – мідь в сірчаній кислоті, яка утворюється при їхньому контакті, вказати катод та анод і написати рівняння реакцій, які відображають суть катодного й анодного процесів. Зробити висновок щодо впливу на швидкість корозії цинку його контакту з міддю.
Дослід 2. Скласти схеми електрохімічної корозії лудженого і оцинкованого заліза. Зробити висновок про те, де проходить швидше корозія заліза. Чому? У якому випадку при руйнуванні захисного покриття (цинку або олова) корозія заліза буде проходити швидше?
Дослід 3. Зробити висновок щодо впливу уротропіну на швидкість корозії цинку.
Питання для самоперевірки
1. Що таке корозія металів?
2. Які існують основні типи корозії?
3. Як впливає на швидкість корозії цинку його контакт з міддю?
4. У чому полягає механізм електрохімічної корозії?
5. Що буде відбуватися при пошкодженні захисного покриття олова на залізному виробі, якщо виріб знаходиться у воді? Скласти рівняння катодного та анодного процесів.
При контакті з яким з двох металів – міддю чи свинцем – залізо буде руйнуватися швидше? Чому?
Лабораторна робота № 18
