
- •0Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Хімічна рівновага
Мета роботи - вивчення впливу концентрації реагуючих речовинна станхімічної рівноваги.
Загальні вказівки
Слід мати на увазі, що хімічна рівновага можлива лише для оборотних реакцій. Стан системи, за якого швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою. Концентрації реагуючих речовин не змінюються і їх називають рівноважними концентраціями. Вони позначаються формулами речовин у квадратних дужках.
Величина, яка дорівнює відношенню добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степенях, що дорівнюють стехіометричним коефіцієнтам, називається константою рівноваги. Наприклад, для оборотної реакції:
![]()
константа рівноваги має вигляд:
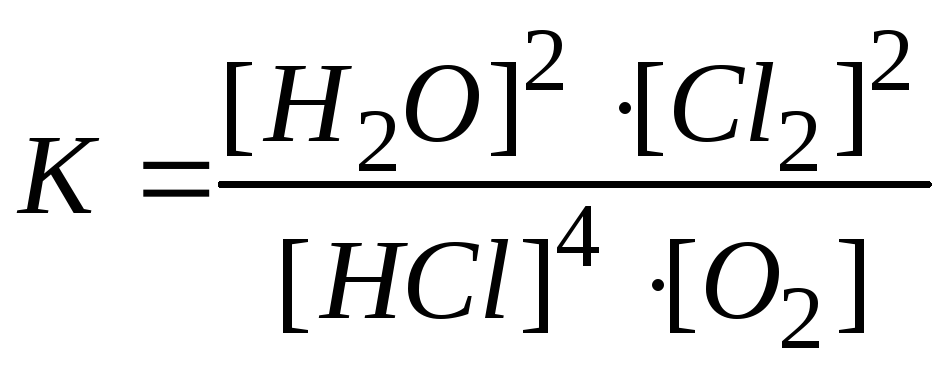
Необхідно звернути увагу на те, що константа рівноваги не залежить від концентрації речовин у системі, а залежить лише від природи реагентів і температури.
Хімічна рівновага залишається незмінною доти, доки залишаються постійними параметри, за яких вона встановилася. При зміні умов рівновага зміщується. Через деякий час у системі знову настає рівновага, яка характеризується новими рівноважними концентраціями всіх речовин і новою рівністю швидкостей прямої і зворотної реакцій.
У загальному випадку напрям зміщення рівноваги визначається за принципом Ле Шательє: якщо на систему, що знаходиться в рівновазі, впливати зовні, то рівновага зміщується у напрямку тієї реакції, яка протидіє зовнішньому впливу.
Порядок виконання роботи
У даній роботі
розглядається оборотна реакція взаємодії
хлориду заліза(Ш) з роданідом калію.
Роданід заліза
![]() надає розчину червоного кольору. За
зміною інтенсивності кольору можна
судити про зміну його концентрації,
тобто про зміщення рівноваги в той чи
інший бік.
надає розчину червоного кольору. За
зміною інтенсивності кольору можна
судити про зміну його концентрації,
тобто про зміщення рівноваги в той чи
інший бік.
Для цього необхідно змішати
в склянці 10 мл розведеного розчину
хлориду заліза
![]() і 10 мл розчину роданіду калію
і 10 мл розчину роданіду калію
![]() .
Розлити приготовлений розчин порівну
в чотири пробірки, одну з яких залишити
як контрольну. В першу пробірку додати
1 мл концентрованого розчину хлориду
заліза, в другу – невелику кількість
кристалічного роданіду калію, в третю
– кристалічний хлорид калію. Розчини
в усіх пробірках розмішати. Відзначити
зміну інтенсивності забарвлення розчину,
порівнюючи його з розчином у контрольній
пробірці.
.
Розлити приготовлений розчин порівну
в чотири пробірки, одну з яких залишити
як контрольну. В першу пробірку додати
1 мл концентрованого розчину хлориду
заліза, в другу – невелику кількість
кристалічного роданіду калію, в третю
– кристалічний хлорид калію. Розчини
в усіх пробірках розмішати. Відзначити
зміну інтенсивності забарвлення розчину,
порівнюючи його з розчином у контрольній
пробірці.
Оформлення результатів роботи
Записати рівняння реакції
між
![]() і
і
![]() .
Зробити висновок щодо напрямку зміщення
рівноваги при додаванні: хлориду заліза,
роданіду калію, хлориду калію.
.
Зробити висновок щодо напрямку зміщення
рівноваги при додаванні: хлориду заліза,
роданіду калію, хлориду калію.
Пояснити зміни кольору, керуючись принципом Ле Шательє, записати вирази закону дії мас для прямої і зворотної реакції, а також константи рівноваги для даної системи.
Питання для самоперевірки
1. Який стан називається станом хімічної рівноваги? Для яких реакцій він характерний?
2. Що таке константа рівноваги?
3. Від яких факторів залежить константа рівноваги?
4. Які фактори впливають на стан хімічної рівноваги?
5. Який принцип визначає напрям зміщення рівноваги? Сформулювати цей принцип.
Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
Мета роботи - набуття навичок приготування розбавленого розчину з більш концентрованого.
Загальні вказівки
Склад розчину виражається концентрацією або часткою розчиненої речовини.
Молярна концентрація (СМ) визначається відношенням кількості речовини до об’єму розчину, моль/л:
![]()
Молярна концентрація еквівалента, або нормальність (СН) визначається відношенням кількості речовини еквівалента до об’єму розчину, моль/л:
![]()
Моляльна концентрація (![]() )
визначається відношенням кількості
речовини до маси розчинника, моль/кг:
)
визначається відношенням кількості
речовини до маси розчинника, моль/кг:

Масова концентрація (або
титр)
![]() визначається відношенням маси розчиненої
речовини до об’єму розчину, г/мл:
визначається відношенням маси розчиненої
речовини до об’єму розчину, г/мл:

Розрізняють такі частки розчиненої речовини: молярну, масову та об’ємну. Найчастіше вживаються масова та молярна частки.
Масова частка
![]() або процентна концентрація С%
визначається відношенням маси розчиненої
речовини до маси всього розчину:
або процентна концентрація С%
визначається відношенням маси розчиненої
речовини до маси всього розчину:
 або
або

Порядок виконання роботи
Дослід 1. Приготування 0,1 н
розчину
![]() з більш концентрованого розчину.
з більш концентрованого розчину.
Спочатку треба розрахувати об’єм (мл) вихідного розчину кислоти, потрібний для приготування 100 мл 0,1 н розчину:
1 л 0,1 н розчину
![]() вміщує 0,1 моль еквівалента
вміщує 0,1 моль еквівалента
![]() .
Молярна маса еквівалента
.
Молярна маса еквівалента
![]() дорівнює молярній масі. Тому в 100 мл 0,1
н розчину
дорівнює молярній масі. Тому в 100 мл 0,1
н розчину
![]() вміщується 0,365 г
вміщується 0,365 г
![]() .
.
Потім необхідно розрахувати,
в якому об’ємі концентрованої соляної
кислоти вміщується розрахована маса
![]() .
З таблиці густини розчинів сильних
кислот і лугів виходить, що соляна
кислота густиною 1,06 г/см3
відповідає 12,2% розчину. Отже,
.
З таблиці густини розчинів сильних
кислот і лугів виходить, що соляна
кислота густиною 1,06 г/см3
відповідає 12,2% розчину. Отже,
у 100 г розчину міститься 12,2 г
![]() ;
;
у Х г розчину міститься 0,365 г
![]()
Звідси:
 (г)
(г)
Для перерахування знайденої маси кислоти на її об’єм потрібно скористатися формулою:

Відміряти розрахований об’єм соляної кислоти за допомогою циліндра на 10 мл, вилити кислоту в мірну колбу на 100 мл і довести дистильованою водою до позначки. Одержаний розчин ретельно перемішати.
Дослід 2. Встановлення концентрації (титру) приготовленого розчину.
Для перевірки концентрації приготовленого розчину соляної кислоти користуються методом титрування, який полягає в тому, що до певного, точно виміряного об’єму кислоти поступово додають з бюретки розчин лугу відомої концентрації до досягнення еквівалентної кількості, яка визначається за допомогою індикатора.
Титрування провести таким
чином. Бюретку вище нульової позначки
наповнити 0,1 н розчином
![]() .
Потім, підставивши під неї колбу або
склянку і відкривши затискач, заповнити
відтягнуту трубку бюретки так, щоб у
ній не залишилось бульбашок повітря.
Встановити рівень розчину на нульовій
позначці.
.
Потім, підставивши під неї колбу або
склянку і відкривши затискач, заповнити
відтягнуту трубку бюретки так, щоб у
ній не залишилось бульбашок повітря.
Встановити рівень розчину на нульовій
позначці.
У конічну колбу перенести піпеткою 10 мл приготовленого розчину кислоти і додати туди 2 – 3 краплі індикатора – фенолфталеїну (в кислому і нейтральному середовищі фенолфталеїн безбарвний, в лужному середовищі має малиновий колір).Колбу з кислотою поставити на аркуш білого паперу (щоб побачити зміну кольору індикатора). Луг додавати по краплях з бюретки в колбу (вміст колби перемішувати) доти, доки від однієї краплі лугу розчин в колбі стане блідо-рожевого кольору. Повторити дослід декілька разів, доки останні три відліки не будуть відрізнятися один від одного не більше як на 0,2 – 0,3 мл.
Оформлення результатів роботи
Дослід 1. Занести в графу
“розрахунки” дані, які необхідні для
приготування 100 мл 0,1 н розчину
![]() .
.
Дослід 2. Результати титрування записати в таблицю:
|
Номер проби |
Об’єм кислоти, мл |
Об’єм лугу, мл |
Нормальність лугу, моль/л |
|
|
|
|
|
Розрахувати нормальність кислоти, користуючись формулою:
![]()
Розрахувати відносну помилку досліду:
 ,
,
де
![]() -
відносна помилка, %;
-
відносна помилка, %;
![]() -
теоретичне значення нормальності
розчину (в даному разі – 0,1);
-
теоретичне значення нормальності
розчину (в даному разі – 0,1);
![]() - обчислене значення нормальності
розчину.
- обчислене значення нормальності
розчину.
Розрахувати титр приготовленого розчину кислоти за формулою:
![]() ,
,
де
![]() - титр приготовленого розчину кислоти,
г/мл;
- титр приготовленого розчину кислоти,
г/мл;
![]() -
нормальність приготовленого розчину
кислоти, моль/л;
-
нормальність приготовленого розчину
кислоти, моль/л;
![]() -
молярна маса еквівалента кислоти,
г/моль.
-
молярна маса еквівалента кислоти,
г/моль.
