
- •0Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Правила техніки безпеки та перша допомога в нещасних випадках
Працюючи в хімічній лабораторії треба постійно пам’ятати про техніку безпеки. Слід враховувати деякі загальні вказівки:
Не можна брати речовини руками та куштувати їх на смак. Для визначення запаху речовин склянку слід тримати на відстані і спрямовувати рухом руки повітря від склянки до носа.
Досліди з концентрованими кислотами та лугами, отруйними та леткими речовинами треба проводити у витяжній шафі.
При додаванні реактивів не можна нахилятися над отвором посудини, щоб уникнути попадання бризок на обличчя та одяг.
Не можна нахилятися над рідиною, що нагрівається, бо її може викинути. При нагріванні рідин у пробірках слід тримати їх отвором вбік від себе та оточуючих.
При розведенні концентрованих кислот, особливо сірчаної, необхідно обережно вливати кислоту в воду!
З легкоспалахуючими рідинами не можна працювати поблизу нагрівальних приладів. У випадку спалахування горючих речовин треба погасити пальник, вимкнути електронагрівальні прилади, відставити посудину з вогненебезпечною речовиною і гасити пожежу.
При порушенні правил техніки безпеки в лабораторії трапляються випадки, що вимагають негайної медичної допомоги – порізи рук склом, опік їх гарячими предметами, кислотами, лугами. Слід пам’ятати основні правила першої допомоги:
При пораненні склом необхідно видалити осколки з рани, змазати край рани розчином йоду і перев’язати бинтом.
При опіку рук або обличчя будь-якою речовиною треба змити її великою кількістю води, а потім або розведеною оцтовою кислотою (у випадку опіку лугом), або розчином соди (у випадку опіку кислотою), а потім знову водою.
При опіку гарячою рідиною або гарячим предметом обпечене місце необхідно обробити свіжоприготовленим розчином перманганату калію, змазати обпечене місце маззю від опіків. Можна присипати опік содою і забинтувати.
При хімічних опіках очей необхідно ретельно промити очі водою, використовуючи спеціальну ванночку, а потім звернутися до лікаря.
Лабораторна робота № 1
ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Мета роботи - ознайомлення з класифікацією та номенклатурою неорганічних сполук.
Загальні вказівки
Неорганічні сполуки поділяють на декілька класів за подібністю хімічної будови та властивостей, як це показано на рис.1.
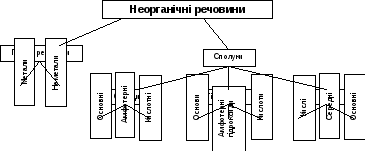
Рис.1. Основні класи неорганічних сполук
Оксидами
називають бінарні сполуки елементів
з киснем (![]() ).
).
За хімічними
властивостями оксиди поділяють на
солетворні й несолетворні. Солетворні
це такі оксиди, які в разі перебігу
хімічних реакцій здатні утворювати
солі. Несолетворні це такі оксиди,
які не здатні утворювати солі. Наприклад,
![]() тощо (таких оксидів відомо мало).
тощо (таких оксидів відомо мало).
Солетворні оксиди, в свою чергу, поділяються на основні, кислотні та амфотерні.
Основними
оксидами називаються оксиди,
гідроксиди яких є основами. До основних
оксидів, як правило, належать оксиди
типових металів (![]() тощо), а такожd-металів
у нижчих ступенях окиснення (
тощо), а такожd-металів
у нижчих ступенях окиснення (![]() тощо).
тощо).
При взаємодії з кислотами або кислотними оксидами вони утворюють солі:
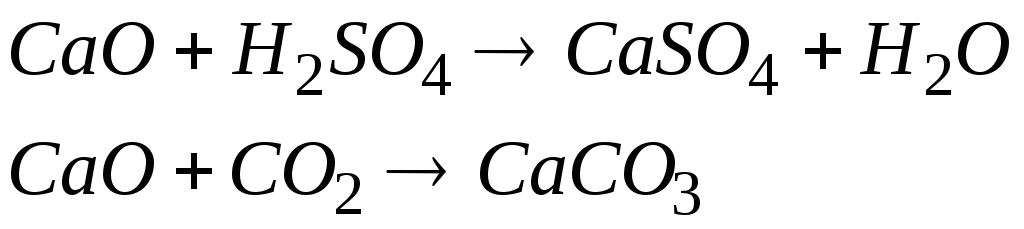
Кислотними оксидами
називаються оксиди,
гідроксиди яких є кислотами. Тому
кислотні оксиди ще називаються ангідридами
кислот. До них належать оксиди неметалів,
а також металів у вищих ступенях
окиснення:
![]() .
.
При взаємодії з основами або з основними оксидами вони утворюють солі:
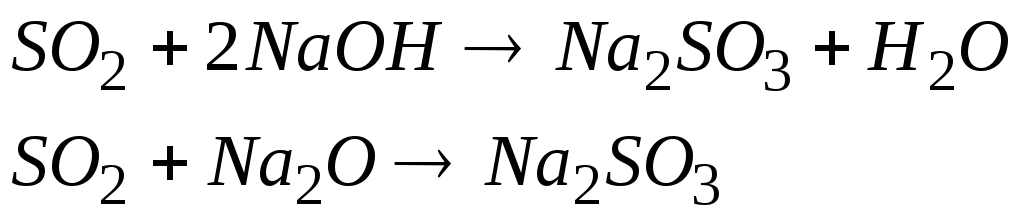
Амфотерні оксиди залежно від умов виявляють властивості кислотних і основних оксидів, тобто утворюють солі при взаємодії як з кислотами, так і з основами:
![]()
![]()
До амфотерних належать оксиди
деяких металів головних підгруп (![]() ),
а також оксиди багатьох d-металів
побічних підгруп періодичної системи
елементів у проміжних ступенях окиснення:
),
а також оксиди багатьох d-металів
побічних підгруп періодичної системи
елементів у проміжних ступенях окиснення:
![]()
![]()
![]() .
.
Назви оксидів елементів, які
мають постійний ступінь окиснення,
згідно з номенклатурними правилами
ІЮПАК , складаються з двох слів: оксид
+ назва елемента в родовому відмінку
(![]() -
оксид магнію).
-
оксид магнію).
Якщо елемент утворює декілька
оксидів, після назви елемента вказують
його ступінь окиснення (римською цифрою
в дужках):
![]() -
оксид феруму (П).
-
оксид феруму (П).
Називати оксиди можна також
додаванням до слова оксид грецьких
числівників:
![]() - діоксид вуглецю.
- діоксид вуглецю.
Основами називають
сполуки, до складу яких входять атом
металу і гідроксильні групи -
![]() .
Число гідроксильних груп у молекулі
основи відповідає валентності металу
і визначає кислотність основи.
.
Число гідроксильних груп у молекулі
основи відповідає валентності металу
і визначає кислотність основи.
З точки зору теорії
електролітичної дисоціації основи –
це електроліти, що дисоціюють у розчині
з утворенням гідроксид-іонів
![]() :
:
![]()
Характерною властивістю основ є їхня здатність взаємодіяти з кислотами й кислотними оксидами з утворенням солей:
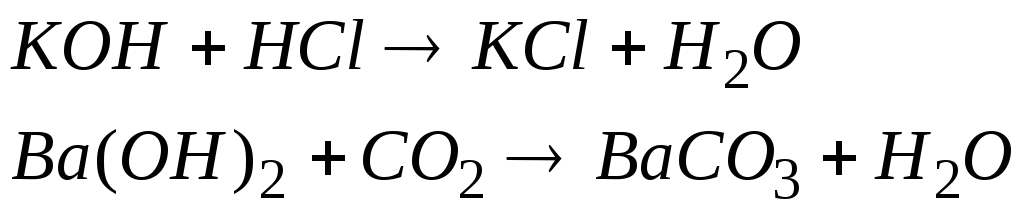
За номенклатурними правилами
ІЮПАК речовини, які містять
![]() -
групи називаються гідроксидами.
-
групи називаються гідроксидами.
Назва основи складається із слів гідроксид + назва металу в родовому відмінку. Якщо метал утворює декілька гідроксидів, ступінь його окиснення вказують римською цифрою в дужках або до слова гідроксид додають префікс від числа гідроксильних груп у основі (див. табл. 1.1).
Таблиця 1.1
