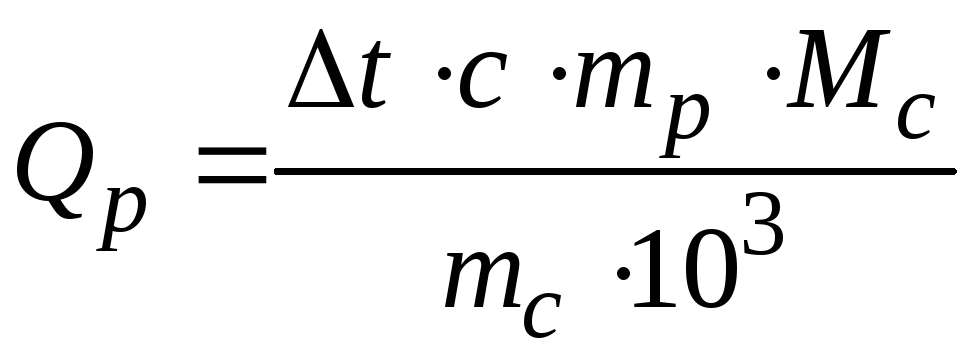- •0Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Питання для самоперевірки
Що називається еквівалентом речовини?
Які елементи мають змінні значення еквівалентів?
Як обчислюється молярна маса еквівалента елемента та складних речовин? У яких одиницях вона виражається?
Чи однакові еквівалентні маси заліза в сполуках
 та хрому в сполуках
та хрому в сполуках
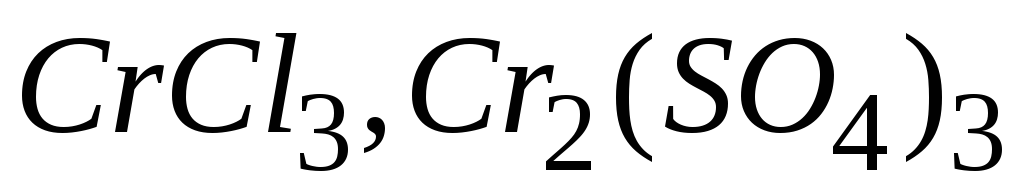 ?
?Як формулюється закон еквівалентів? Його математичний вираз.
На чому базується метод визначення молярної маси еквівалента карбонату кальцію?
Обчислити молярну масу еквівалента міді, якщо відомо, що 3,18 г міді повністю сполучилися с 0,8 г кисню, утворивши оксид міді (II).
Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
Мета роботи - визначення теплоти гідратації солі на основі калори-метричних вимірювань.
Загальні вказівки
Під теплотою гідратації солі слід розуміти тепловий ефект реакції утворення кристалогідрату з безводної солі, віднесений до одного молю речовини.
Оскільки в хімії часто
відбуваються процеси при сталому тиску
і сталій температурі, то слід мати на
увазі, що в ізобарно-ізотермічних
процесах тепловий ефект реакції
визначається зміною ентальпії системи
![]() в процесі реакції, яка пов’язана з
теплотою, що виділяється або поглинається
співвідношенням:
в процесі реакції, яка пов’язана з
теплотою, що виділяється або поглинається
співвідношенням:
![]()
У зв’язку з тим, що безпосередньо теплоту гідратації солі визначити важко, її знаходять на основі закону Гесса, визначаючи теплоти розчинення безводної солі та її кристалогідрату.
Згідно з законом Гесса,тепловий ефект реакції не залежить від шляху її перебігу, а залежить лише від природи і фізичного стану вихідних речовин та продуктів реакції.
Таким чином, загальний тепловий ефект процесу розчинення кристалічної речовини дорівнює сумі теплових ефектів окремих стадій, що складають процес розчинення:
![]()
У даній роботі процес розчинення у воді сульфату міді можна зобразити у вигляді двох стадій:
![]()
Перша стадія процес гідратації солі, тобто утворення кристалогідрату сульфату міді, друга стадія розчинення кристалогідрату у воді. Сумарне рівняння процесу розчинення безводної солі має вигляд:
![]()
Визначивши експериментально
за допомогою калориметра теплові ефекти
процесів розчинення
![]() ,
можна розрахувати теплоту гідратації
солі
,
можна розрахувати теплоту гідратації
солі
![]() за законом Гесса
за законом Гесса
![]()
Порядок виконання роботи
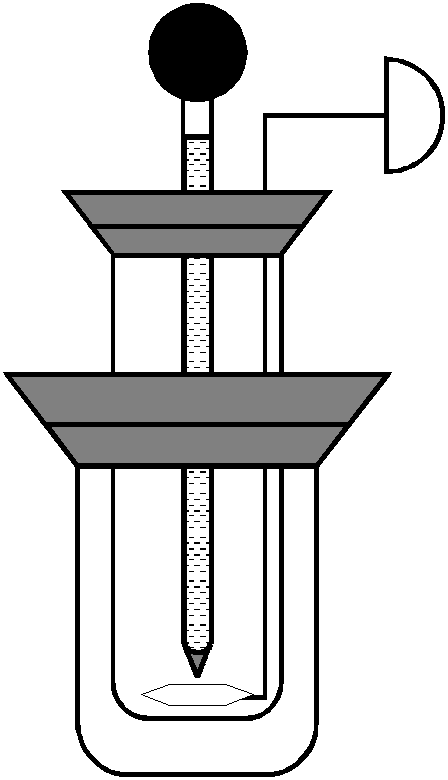
Дослід проводиться у спрощеному
калориметрі (рис. 3). У внутрішню посудину
налити 25 мл дистильованої води. Опустити
у воду термометр і заміряти температуру
з точністю до 0,10С
– початкову температуру досліду
![]() Висипати наважку безводної солі в
посудину з водою. Обережно перемішуючи
розчин мішалкою, слідкувати за зміною
температури, відмітити найвищу температуру
розчину
Висипати наважку безводної солі в
посудину з водою. Обережно перемішуючи
розчин мішалкою, слідкувати за зміною
температури, відмітити найвищу температуру
розчину
![]() .
.
Дослід повторити, взявши
наважку кристалогідрату. При проведенні
досліду слід звернути увагу на пониження
температури при внесенні кристалогідрату
і відмітити найнижчу температуру розчину
![]()
|
Оформлення результатів роботи
Записати в лабораторний журнал дані досліду для обох солей: - -
об’єм води -
початкова температура
- максимальна (мінімальна) температури
( Розрахувати
Визначити кількість теплоти, що виділяється або поглинається при розчиненні безводної солі та кристалогідрату, у перерахуванні на 1 моль речовини за формулою:
де
|
Рис. 3 Калориметрична установка
1– мішалка, 2 – калориметричний стакан, 3 – зовнішня посудина, 4 – кришка, 5 – термометр |
Записати теплові ефекти розчинення двох солей виходячи з того, що
![]()
Розрахувати теплоту гідратації солі
![]() .
.
Розрахувати відносну помилку досліду:
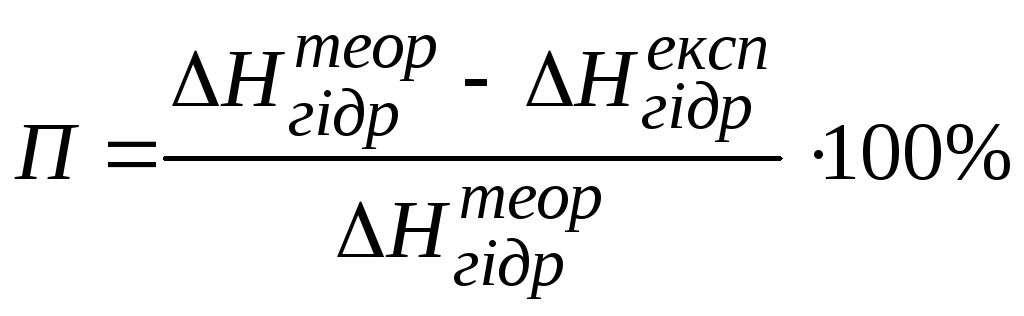 ,
,
де П– відносна помилка, %;
![]() ;
;
![]() - розраховане значення теплоти гідратації.
- розраховане значення теплоти гідратації.
Питання для самоперевірки
Чим визначається тепловий ефект хімічної реакції? У яких одиницях він вимірюється?
Що називається теплотою утворення речовин?
Теплоти утворення яких речовин дорівнюють нулю?
Який закон лежить в основі термохімічних розрахунків? Сформулювати цей закон.
Що називається теплотою гідратації солі? Як можна розрахувати теплоту гідратації солі?
Лабораторна робота № 4


 маса солі
маса солі